Einleitung
 |
| Abb. 1: Verlauf des Laserstrahls bei 1/e der maximalen Intensität. |
Die Multiphotonenmikroskopie stellt eine neuartige 3D Mikroskopie dar, die auf der beugungsbegrenzten Fokusierung von Laserstrahlung im nahen infraroten (NIR) Spektralbereich beruht. Sie erfordert eine extrem hohe Konzentration von Photonen in Raum und Zeit, d.h. hohe Intensitäten bzw. hohe Photonenflußdichten. Bei extrem hohen Lichtintensitäten von MW/cm2 bis TW/cm2 besteht die Möglichkeit einer simultanen Absorption von zwei NIR Photonen (Zweiphotonen-Mikroskopie) oder drei NIR Photonen. Ihre geringen Photonenenergien addieren sich und ermöglichen den Übergang in elektronische Zustände, die sonst nur mit UV oder kurzwelliger sichtbarer Strahlung möglich wären. Zum Beispiel können 780 nm Photonen Zustände anregen, die sonst nur mit 390 nm (Zweiphotonen-Prozess) oder 260 nm (Dreiphotonen-Prozess) angeregt werden könnten. NIR Photonen können so UV-Effekte induzieren und sichtbare Fluoreszenzen anregen. Die notwendigen hohen Lichtintensitäten keonnen mit cw Strahlung z.B. von 100 mW Leistung (also mit Laserpinzetten), günstiger jedoch mit sehr kurzen Pulsen hoher Pulsleistung im Watt und kW Bereich und kleiner mittlerer mW Leistung erzeugt werden. Übelicherweise werden Femtosekundenpulse eines Ti.Saphir Lasers verwendet bei einer Pulsfolgefrequenz von 80 MHz. Die Multiphotonenanregung erfolgt nur in einem Sub-Femtoliter-Fokusvolumen. Mittels Scanningeinheit (Verschiebung des Anregungsvolumens durch die Probe) ist so eine Pinhole-freie 3D-Mikroskopie möglich. Es erfolgt keine Photobelastung und kein Ausbleichen ausserhalb des Fokusbereiches. Prinzipiell sind 3D Aufnahmen mit Submikrometer-Auflösung bis zu einer Gewebetiefe von 0.5 - 1 mm möglich. Bei zu hoher Intensität erfolgt eine Zellschädigung durch UV-Effekte und optischen Durchbruch bzw. Plasmabildung.
Ziele
Die Haut stellt für das Eindringen der meisten chemischen Stoffe
eine große Barriere dar, was zwar einen hervorragenden Schutz des
Körpers vor der Umgebung darstellt, aber hinsichtlich der Entwicklung
von transdermalen Wirkstoffen problematisch ist. Die vielfältigen
Vorteile solcher transdermalen Applikation gegenüber konventioneller
Arzneimittelverabreichung erklären die immensen Untersuchungen der
beiden letzen Jahrzehnte zu diesem Forschungsgebiet. Dabei war es vor allem
spektroskopischen physikalischen Untersuchungstechniken wie der Fouriertransform-Infrarotspektroskopie
(FTIR), der Kernspinresonanztechnik (NMR), der Elektronspinresonanztechnik
(ESR) und der Fluoreszenz-Polarisationsspektroskopie zu verdanken, die
Barrierefunktion der Epidermis und den Permeationsweg auf molekularer Ebene
in Grundzügen zu verstehen. Für die Barrierefunktion der Epidermis
sind polare und neutrale Lipide, Sphingolipide und Cholesterin verantwortlich.
Im lipophilen Bereich (Grenzschicht zwischen Stratum ganulossum und Stratum
corneum) werden nach dem Absterben des Zellkerns Lipide in hoher Konzentration
frei, die die Zellmasse und den interzellularen Raum durchsetzen und so
für eine hohe Lichtduchlässigkeit sorgen. Um fundiertere
Erkenntnisse auf einer molekularen Basis zu gewinnen, scheint es angebracht,
neuartige spektroskopische Techniken einzusetzen, die im Gegensatz zu den
oben genannten Techniken über ausreichendes räumliches Auflösungsvermögen
- insbesondere senkrecht zur Hautoberfläche - verfügen, um auf
molekularem Niveau die Epidermis und die dort ablaufenden Transportvorgänge
besser studieren zu können und um so ein Instrumentarium bereitzustellen,
daß auch die weitere Erforschung von "Enhancern" für die Penetration
von Wirkstoffen ermöglicht. Weiterhin sollte die Untersuchungstechnik
so schonend sein, daß Experimente prinzipiell auch in vivo durchgeführt
werden können.
Es wurde bereits gezeigt, daß die Mehrphotonenanregung von Fluorophoren geeignet ist, eine axiale Auflösung um 100 nm zu erreichen. Doch welche Vorteile bietet der Einzelmolekülnachweis mittels der Zweiphotonenanregung für Untersuchungen an der Haut?
In diesem Zusammenhang soll auch die Rolle von Molekülen untersucht
werden, die das Eindringen von Wirkstoffen in die Haut verbessern. Wirkstoffe,
die die Haut nur schlecht absorbiert, können zwar nicht direkt transdermal
genutzt werden, jedoch kann durch Zugabe eines geeigneten "Enhancers" der
Transport durch die Haut ausreichend erhöht werden, um therapeutische
Konzentrationen zu applizieren. Ein solcher "Enhancer" sollte die folgenden
idealen Eigenschaften besitzen:
- pharmakologisch inert, chemisch und physikalisch stabil, farb-, geschmacks-,
und geruchslos
- nicht toxisch, irritierend oder allergieauslösend
- die Wirkung sollte spezifisch, reversibel, schnell und von vorhersehbarer
Dauer sein.
Azone (generischer Name "Laurocapram" sind ein häufig eingesetztes Mittel als "Enhancer", die nicht nur zur Verbesserung der Absorption von Wirkstoffen durch die Haut eingesetzt werden können, sondern an denen auch das Design von transdermalen Systemen prototypisch untersucht und optimiert werden kann - vorausgesetzt unser Verständnis der ablaufenden Prozesse beruht auf einer molekularen Basis.
Der Einfluß von "Azonen" auf Liposome wurde auch anhand von fluoreszierenden
Proben, die in die Liposome eingebracht wurden, untersucht. Danach erscheint
es plausibel, daß Azone die strukturierten Lipide "verflüssigen",
d.h. die Viskosität erniedrigen und damit die Diffusion von eindringenden
Stoffen erhöhen . Untersuchungen durch differentielle Kalorimetrie
legen den Schluß nahe, daß Azone nicht in die "Corneocyten"
eindringen, sondern sich interzellulär verbreiten (Der Porentransport,
sei er transglandulär oder transfollikulär, wird aufgrund der
geringen Porenfläche von ca. 1/1000 gegenüber der Gesamthautfläche
vernachlässigt). Durch den Einzelmolekülnachweis soll die molekulare
Umgebung der Enhancer näher analysiert werden, um so den Mechanismus
und die Route der Wirkstoffeindringung in Verbindung mit Enhancern besser
zu verstehen.
Experiment
Zur Demonstration des Einzelmolekülnachweises mittels Zweiphotonenanregung
wurde ein gepulstes Titan-Saphir-Lasersystem eingesetzt, das von einem
Argonionenlaser gepumpt wurde. Der Wellenlängenbereich liegt bei 820
- 890 nm; die mittlere Leistung ist wellenlängenabhängig und
liegt bei einigen 100 mWatt (600 mW bei 850 nm) bei einer Wiederholrate
von 76 MHz und einer Einzelpulslänge von 200 fs.
Zunächst wurde der Zweiphotonenabsorptionsquerschnitt verschiedener bekannter und neuer Farbstoffe bestimmt, wobei auch erstmalig Daten zum pharmakologischen Wirkstoff Triamteren gewonnen wurden. Die gute Übereinstimmung mit den Literaturdaten demonstriert die Eignung der Untersuchungsmethode. Zum Einzelmolekülnachweis wurde Coumarin 307 in immer größerer Verdünnung eingesetzt. Der Laserstrahl wurde nach Passieren eines dielektrischen Spiegels mit einem Mikroskopobjektiv fokussiert und das Fluoreszenzsignal mit einem Photomultiplier detektiert. Dabei ist anzumerken, daß lediglich die über einige Sekunden gemittelte integrale Signalintensität registriert wurde, was natürlich dem einzusetzenden Photoncounting unterlegen ist. Dennoch lag die nachweisbare mittlere Molekülzahl im Fokusbereich deutlich unter eins (0,05 Moleküle).
Das Lasersystem (Ar+-gepumpter Titan-Saphir-Laser) ist zentraler Bestandteil der Untersuchungen. Um für den Einzelmolekülnachweis ein optimales Signal/Rausch-Verhältnis zu erzielen, sollte die Anregungsintensität der Laserstrahlung möglichst hoch sein, aber andererseits nicht zu einer vollständigen Sättigung des spektralen Übergangs führen, da dann der große Vorteil der Zweiphotonenmikroskopie, die instrinsische Tiefenauflösung, zunichte gemacht wäre. Bei einer Wiederholfrequenz von 76 MHz, einer Fokussierung auf 0.4 mm und einer Pulslänge von 200 fs bedeutet dies eine maximal zulässige mittlere Leistung von ca. 10 mW, die problemlos vom Lasersystem geliefert werden kann. Es ist also sichergestellt, daß nahezu die gleiche Anregungswahrscheinlichkeit wie bei der konventionellen Einphotonenanregung erzielt wird, daß jedoch bezüglich der z-Achse mit einer ausgezeichneten Auflösung und keinerlei Streulicht (Rauschen) zu rechnen ist - von den weiteren Vorteilen (s.o.) ganz abgesehen.
Für den realistischen Einsatz einer Objektlinse, die bei einer maximalen Entfernung von 1.5 mm und einer Ausleuchtung von mehr als 3 mm eine numerische Apertur von NA = 0,7 aufweist, sind die Intensitätsverteilungen in den beiden unteren Abbildungen dargestellt. Prinzipiell ist es denkbar, die numerische Apertur bis um den Faktor 2 zu erhöhen (bessere Objektlinse, Immersionsflüssigkeit), was eine entsprechend bessere Auflösung zur Folge hätte.
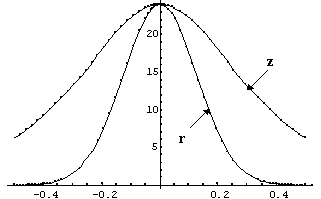
Die (quadratische) Intensitätsverteilung in der Umgebung des Fokus
ist bezüglich der z-Achse und senkrecht dazu (radiale r-Abhängigkeit)
in Abb. 2 dargestellt. Zur Verdeutlichung der Intensitätsverteilung
bei dem von uns einzusetzenden Zweiphotonenmikroskop ist in der Abb. 3
ein Konturplot von I2(r,z) dargestellt, aus dem ebenfalls das
gute Auflösungsvermögen hervorgeht: die Achsenlänge bzgl.
r (horizontale Skala) und z (vertikale Skala) beträgt nur 1 µm.
 |
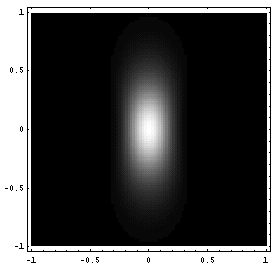 |
| Abb. 2: I2(r) und I2(z) im Fokus. Die Längeneinheiten sind in µm gegeben. Bei der Zweiphotonenanregung entspricht die Tiefenauflösung (z) nahezu der lateralen Auflösung (r). | Abb. 3: Der Konturplot I2(r,z) gibt die Anregungswahrscheinlichkeit und damit das Auflösungsvermögen wider. Die vertikale Skala entspricht der z-Achse, die horizontale repräsentiert die radiale Abhängigkeit. |
Das im sichtbaren Spektralbereich emittierte Fluoreszenzlicht wird von
der Objektlinse gesammelt und über einen dichroitischen Spiegel vom
Anregungslicht im nahen IR getrennt. Da der Brechungsindex der Objektlinse
für das Fluoreszenzlicht etwas größer ist als für
das Anregungslicht, wirkt die Objektlinse schwach fokussierend. Nach dem
dichroitischen Spiegel soll optional ein dielektrischer Polarisator eingesetzt
werden, der dann die getrennte Beobachtung der beiden Polarisationsebenen
ermöglicht. Im Strahlengang des Fluoreszenzlichtes befindet sich noch
ein spektraler und ein räumlicher Filter, wobei aber die räumliche
Filterung nach unseren Erfahrungen nur sehr grob zu erfolgen braucht, so
daß das Gesamtsystem nicht sehr justieranfällig ist und
achromatische Effekte durch unterschiedliche Fluoreszenzwellenlängen
nicht die Detektion und Auflösung beeinflussen. Die Registrierung
des Lichtes übernimmt eine "Lawinen-Diode", deren Einsatz beim Einzelmolekülnachweis
mit Einphotonenanregung schon etabliert ist. Die 3D-Bilder werden im Scan-Betrieb
erzeugt.
Links
http://www.mti.uni-jena.de/~i6koka/vorlesung2/vorl24.html
http://www.mpibpc.gwdg.de/inform/25years/Hell.html
http://www.mti.uni-jena.de/~i6koka/vorlesung2/vorl2.html
Auf diesem Webangebot gilt die Datenschutzerklärung der TU Braunschweig mit Ausnahme der Abschnitte VI, VII und VIII.