Meßprinzip und Charakterisierung der Ramanspektroskopie
(übernommen von der TU-Dresden)
In einem klassischen Raman-Experiment bestrahlt man Moleküle mit
einem nachträglich fokussierten Laserstrahl. Die Wellenlänge
l0 muß so gewählt werden,
daß sie von der Substanz nicht absorbiert wird. Die unter einem Winkel
von 90° (Flüssigkeiten, Gase) bzw. 180° (Festkörper)
austretende Streustrahlung wird durch ein Gitterdoppelmonochromator spektral
zerlegt. Die Intensität der spektral zerlegten Streustrahlung wird
von einem Detektor (CCD-Kamera) gemessen. Die Aufzeichnung der Streustrahlungsintensität
als Funktion der Wellenzahl erfolgt durch die entsprechende Gerätesoftware.
Im Gegensatz zu dispersiven Geräten werden bei der Fourier-Transform-Ramanspektroskopie
Interferometer zur Analyse des gestreuten Lichtes eingesetzt. Vorteile
dieses Systems sind sein großer Lichtleitwert (Jaquinot- Vorteil),
die zeitgleiche Registrierung der Strahlungsintensität über den
gesamten Wellenlängenbereich (Multiplex- oder Felgett- Vorteil) und
die hohe Wellenzahlgenauigkeit (Connes- Vorteil).
Folgende Beobachtungen können bei einem Raman-Experiment gemacht
werden:
-
der größte Teil der Erregerstrahlung tritt ohne Wechselwirkung
durch die Probe hindurch (Transmission)
-
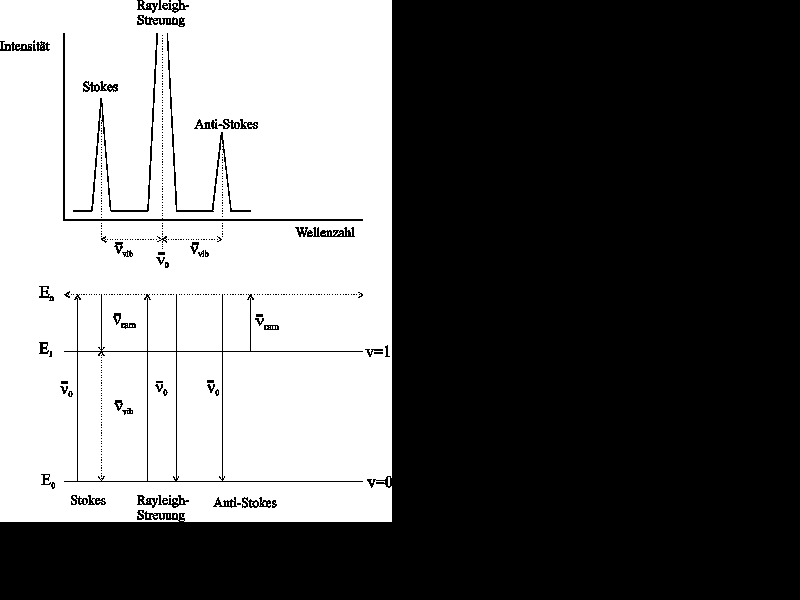
ein Teil der Laserstrahlung wird ohne Energieänderung von den Probemolekülen
in alle Raumrichtungen gestreut (Rayleigh-Streustrahlung der Energie E0)
-
der kleinste Teil der einfallenden Strahlung wird nach Wechselwirkung mit
den Probemolekülen als Raman-Strahlung der Energie E0-Ei
(Stokesstrahlung) bzw. E0+Ei (Anti-Stokesstrahlung)
gestreut, wobei die Energiedifferenzen Ei identisch sind
-
die Intensität der Stokesschen Streustrahlung ist bei Raumtemperatur
wesentlich größer als die der Anti-Stokes-strahlung
Wie lassen sich diese Beobachtungen erklären?
Der Ramaneffekt beruht auf der Streuung elektromagnetischer Strahlung
an Probenmolekülen. Wird das Erregerlicht ohne Veränderung der
Wellenlänge gestreut, so handelt es sich um die Rayleigh-Streustrahlung.
Wird durch die elektromagnetische Strahlung eine Molekülschwingung
angeregt, dann erhält man die Stokessche und Anti-Stokessche Streustrahlung.
Bei der Stokesschen Streustrahlung gehen Moleküle, die sich im Schwingungsgrundzustand
befinden, durch Aufnahme von Energie des eingestrahlten Lichtes in einen
angeregten Schwingungszustand über. Die Streustrahlung ist demnach
längerwelliger. Bei der Anti-Stokesschen Streustrahlung befinden sich
bereits Moleküle im angeregten Schwingungszustand und können
ihre Energie an die Erregerstrahlung abgeben und in einen energieärmeren
Zustand übergehen. Die Streustrahlung ist kürzerwelliger. Da
sich Moleküle bei Raumtemperatur meist im Grundzustand befinden, sind
diese Übergänge wesentlich seltener und ihre Intensitäten
fallen dementsprechend gering aus.
Der Ramaneffekt ist wie die IR-Spektroskopie an bestimmte Auswahlregeln
gebunden. Nur die Schwingungen, die zu einer Änderung der Polarisierbarkeit
a der Elektronenhülle führen, sind
ramanaktiv.
da/ dr¹0
Neben der Frequenz und Intensität ist in der Ramanspektroskopie
der Depolarisationsgrad bedeutend. Der Depolarisationsgrad ergibt sich
aus der Wechselwirkung von polarisiertem Licht mit dem Molekül.
a) isotrop polarisierbares Molekül <=> Streulicht vollständig
polarisiert
b) anisotrop polarisierbares Molekül <=> Streulicht anteilig
depolarisiert
Diesen Effekt mißt man mit Hilfe eines Polarisationsfilters. Man
verdreht den Filter so, daß für eine bestimmte Richtung eine
maximale Intensität beobachtet wird. Dies ist die Intensität
I(parallel) für vollständig polarisiertes Licht. Verdreht man
den Polarisator um 90°, so verringert sich die Intensität auf
I(senkrecht). Der Depolarisationsgrad ist wie folgt definiert:
p=Isenkrecht/Iparallel
Der Depolarisationsgrad dient zur Beschreibung der Symmetrie von Schwingungen:
totalsymmetrische Schwingungen isotroper Moleküle => p = 0
totalsymmetrische Schwingungen anisotroper Moleküle => 0 < p
< 0.75
nicht totalsymmetrische Schwingungen => p = 0.75
Komplementarität von Raman- und IR- Spektroskopie
Die Ramanspektroskopie ist wie die IR-Spektroskopie eine Methode zur Registrierung
der Schwingungsspektren gasförmiger, flüssiger und fester Proben
und damit neben anderen Anwendungen ein wichtiges Hilfsmittel der instrumentellen
Analytik zur Stoffidentifizierung (charakteristische Schwingungen funktioneller
Gruppen, Spektrenvergleiche). Sie unterliegt jedoch anderen Auswahlregeln,
so daß sich Raman- und IR-Spektrum einer Substanz sowohl bezüglich
der Bandenaktivität als auch der Intensitäten unterscheiden.
Symmetrische zweiatomige Moleküle wie Wasserstoff, Stickstoff, Sauerstoff,
liefern ein Raman-Spektrum aber kein IR-Spektrum. Die C=C-Valenzschwingung
des Ethens erscheint im Raman-Spektrum als intensive Bande, während
sie im IR-Spektrum nicht zu beobachten ist. Gleiches gilt für die
totalsymmetrische Valenzschwingung des Benzens. Bei aus Symmetriegründen
in beiden Methoden erlaubten Schwingungen kann in vielen Fällen ein
umgekehrtes Intensitätsverhältnis beobachtet werden. Im allgemeinen
ergänzen sich Raman- und IR-Spektrum gegenseitig und sind daher gut
geeignet, um eine Substanz eindeutig zu charakterisieren.
Bei verschiedenen Fragestellungen findet die Ramanspektroskopie bevorzugte
Anwendung. Wäßrige Lösungen können mit der IR-Spektrometrie
nur unter Verwendung von speziellem Küvettenmaterial untersucht werden.
Auch im niederfrequenten Wellenzahlbereich ist die Ramanspektroskopie im
Gegensatz zur Komplementärmethode ohne zusätzlichen experimentellen
Aufwand einsetzbar.
Aufgaben
-
Registrieren Sie die Ramanspektren der unbekannten Substanzen. Versuchen
Sie dabei auch intensitätsschwache Banden zu erfassen.
-
Bestimmen Sie die Schwingungswellenzahlen und relativen Intensitäten
aller Banden.
-
Ordnen Sie die Banden jedes Spektrums mit Hilfe von Tabellen charakteristischen
Gruppenschwingungen zu (Geeignete Tabellen finden Sie in den Literaturstellen
/1/ und /2/).
-
Identifizieren Sie mit Hilfe der Resultate aus 2. und 3. sowie des Schrader/Meier-Atlas
die gemessenen Substanzen.
-
Vergleichen Sie die Bandenaktivität, die Wellenzahlen und die Bandenintensitäten
der IR- und Ramanspektren der identifizierten Substanzen. Stellen Sie Gemeinsamkeiten
und Unterschiede fest und diskutieren Sie diese auf der Grundlage Ihrer
spektroskopischen Kenntnisse. Versuchen Sie, insbesondere Ihre Kenntnisse
über die Schwingungsauswahlregeln anzuwenden.
-
Führen Sie eine Messung des Depolarisationsgrades an einer vorgegebenen
Substanz aus.
-
Messung biologischer Proben.
-
Messung von Werkstoffschichten mit Hilfe des Ramanmikroskopes.
Wiederholen Sie vor Antritt des Praktikums noch einmal folgende Punkte:
-
Prinzipielle Arbeitsweise eines Gaslasers und Eigenschaften von Laserstrahlung.
-
Welcher Zusammenhang besteht zwischen Energie, Frequenz, Wellenzahl und
Wellenlänge der elektromagnetischen Strahlung?
-
Welchen Einfluß hat das Ausbreitungsmedium auf die genannten Eigenschaften?
-
Schwingungsarten (Grundschwingung, Kombinationsschwingung, Oberschwingung,
Entartung,...) und Strukturaufklärung (Substanzklassen, funktionelle
Gruppen) in der Ramanspektroskopie.
-
Grundlagen der Ramanspektroskopie (Ramaneffekt, Auswahlregeln, Ramanspektren,
Depolarisationsgrad, Aufbau eines Ramanspektrometers,...).
Literatur
-
E. Steger u.a. „Strukturanalytik" Deutscher Verlag für Grundstoffindustrie,
Leipzig/Stuttgart 1992
-
E.Steger u.a. „Strukturaufklärung, Spektroskopie und Röntgenbeugung",
Arbeitsbuch 3 des Lehrwerkes Chemie, Deutscher Verlag für Grundstoffindustrie,
Leipzig
-
K. Doerffel u.a. „Analytikum", Deutscher Verlag für Grundstoffindustrie,
Leipzig
-
M. Hesse u.a. „Spektroskopische Methoden in der organischen Chemie", Georg
Thieme Verlag, Stuttgart-New York
-
M. Otto „Analytische Chemie", VCH 1995
-
J. Weidlein, U. Müller, K. Dehnicke „Schwingungsspektroskopie", Georg
Thieme Verlag, Stuttgart-New York
-
B. Schrader, „Infrared and Ramanspectroscopy", VCH
Auf diesem Webangebot gilt die Datenschutzerklärung der TU Braunschweig mit Ausnahme der Abschnitte VI, VII und VIII.

