Bislang ist die thermische Zustandsgleichung nur für reine Stoffe behandelt worden. Wird eine ideale Gasmischung aus n1 mol der Gasart 1, n2 mol der Gasart 2 usw. hergestellt, die sämtliche die gleiche Temperatur T haben und unter dem gleichen Druck p stehen, so setzt sich das Volumen additiv aus den Volumina zusammen, die die einzelnen Gasarten einnehmen:
Das Volumen, dass von einem Mol eines Stoffes eingenommen wird, ist für alle Stoffe gleich, d.h. Vmi = Vm.
Ersetzt man unter dem Summenzeichen das molare Volumen Vm durch das ideale Gasgesetz, so folgt
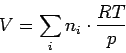
wobei p der Druck ist, unter dem die Gasmischung steht. Durch multiplizieren mit p und dividieren durch V folgt
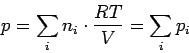
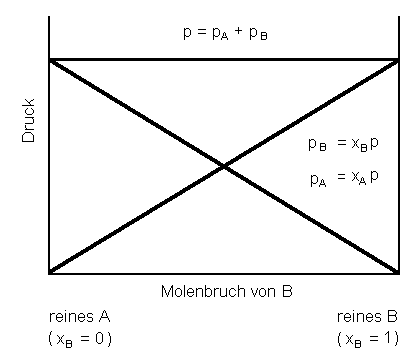 |
| Abb. 1: Die Partialdrücke pA und pB einer Zweikomponenten-Mischung aus perfekten Gasen mit dem Gesamtdruck p bei Veränderung der Zusammensetzung der Mischung von reinem A bis zu reinem B. Die Summe der Partialdrücke ist gleich dem Gesamtdruck, p = pA+ pB. |
Dies ist die mathematische Formulierung des Daltonschen Gesetzes. Es besagt, dass die Summe der Partialdrücke pi gleich dem gemessenen Gesamtdruck p ist (Biographisches über Dalton gibt's hier). Unter dem Partialdruck pi verstehen wir dabei den Druck, den das Gas i annehmen würde, wenn ihm allein das Gesamtvolumen V zur Verfügung stehen würde. Weiterhin gilt:
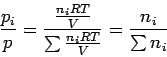
|
|
wobei wir gleich den Molenbruch xi der Komponente
i eingeführt haben, der definitionsgemäß durch den Quotienten
aus der Stoffmenge ni der Komponente i und der Summe der Stoffmengen
aller Komponenten der Phase gegeben ist. In einer idealen Gasmischung ergibt
er sich also auch als Verhältnis des Partialdrucks zum Gesamtdruck.
In der Abbildung sind die Verhältnisse für zwei ideale Gase
A und B dargestellt.
![]()
Auf diesem Webangebot gilt die Datenschutzerklärung der TU Braunschweig mit Ausnahme der Abschnitte VI, VII und VIII.