 |
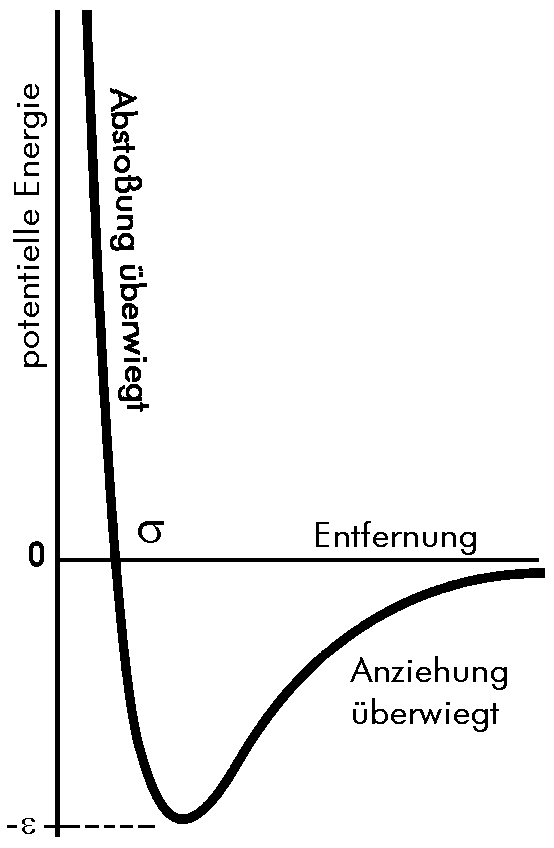
| Abb. 1: Die Änderung der potentiellen Energie zweier Moleküle als Funktion des Abstandes (Lennard-Jones 6-12-Potential). Große positive Energien bei kleinen Abständen kommen dadurch zustande, dass hier die abstoßenden Wechselwirkungen stark überwiegen. Bei mittlerem Abstand dominieren die Anziehungskräfte und die potentielle Energie ist deutlich negativ. Wenn die Entfernung zwischen den Molekülen hinreichend groß wird, treten beide nicht mehr miteinander in Wechsel-wirkung; die potentielle Energie wird null. |
Reale Gase erfüllen die Zustandsgleichung des idealen Gases nicht
exakt. Dabei werden die Abweichungen um so signifikanter, je höher
der Druck und je niedriger die Temperatur ist; am deutlichsten wirken sie
sich am Punkt der Kondensation zur Flüssigkeit aus. Der Grund für
die Abweichung realer Gase vom idealen Verhalten ist die zwischenmolekulare
Wechselwirkung: Gegenseitige Abstoßung der Moleküle begünstigt
die Expansion, Anziehungskräfte begünstigen die Kompression.
Die Abstoßung zwischen neutralen Molekülen ist eine Kraft mit
(auch im Vergleich zum Moleküldurchmesser) kurzer Reichweite, die
erst dann signifikant in Erscheinung tritt, wenn sich die Moleküle
fast berühren (s. Abbildung). So kleine mittlere zwischenmolekulare
Abstände sind nur bei hoher Teilchendichte zu erwarten. Sie
kommt hauptsächlich durch die elektrostatische Abstoßung zwischen
den äußeren Elektronenwolken der Moleküle zustande. Es
gilt für die Kraft dieser Repulsion: FR ~ - r-13.
Anziehungskräfte besitzen dagegen eine relativ große Reichweite,
sie wirken über einige Moleküldurchmesser hinweg. Die Anziehungskräfte
sind auf eine besondere Elektronenanordnung in einem Molekül relativ
zu einem anderen Molekül zurückzuführen. Daher sind sie
bei Abständen mittlerer Länge interessant; bei großer zwischenmolekularer
Entfernung (am äußeren rechten Rand der Abb.) spielen sie keine
Rolle mehr. Die Anziehungskräfte, auch Londonsche oder Dispersionskräfte
genannt, sind näherungsweise umgekehrt proportional zur 7. Potenz
des Abstandes r, FA ~ r-7. Im allgemeinen ist es
einfacher, statt der Kraft die potentielle Energie V(r) zu betrachten,
F = - dV(r)/dr. Für das Potential, als Summe von Abstoßung und
Anziehung, erhält man dann
|
|
wobei ε die maximale Anziehungsenergie (Tiefe
des Potentials) ist. Für r = σ und r → ∞ wird V(r) = 0. Man nennt dieses Potential Lennard-Jones
6-12-Potential.
Unabhängig von der spezifischen Gestalt des Wechselwirkungspotentials
gilt, dass sich ein Gas ideal verhält, wenn die Moleküle
weit voneinander entfernt sind, so dass zwischenmolekulare Wechselwirkungen
ohne Einfluss sind - das heißt, bei geringem Druck. Bei mäßigem
Druck dominiert die Anziehung, da die Entfernung zwischen zwei Molekülen
nur einige Teilchendurchmesser beträgt. Ein solches Gas sollte leichter
komprimierbar sein als ein ideales. Bei weiterer Druckerhöhung überwiegen
schließlich die Abstoßungskräfte, so dass das Gas
schwer zu komprimieren ist.
Der Kompressionsfaktor
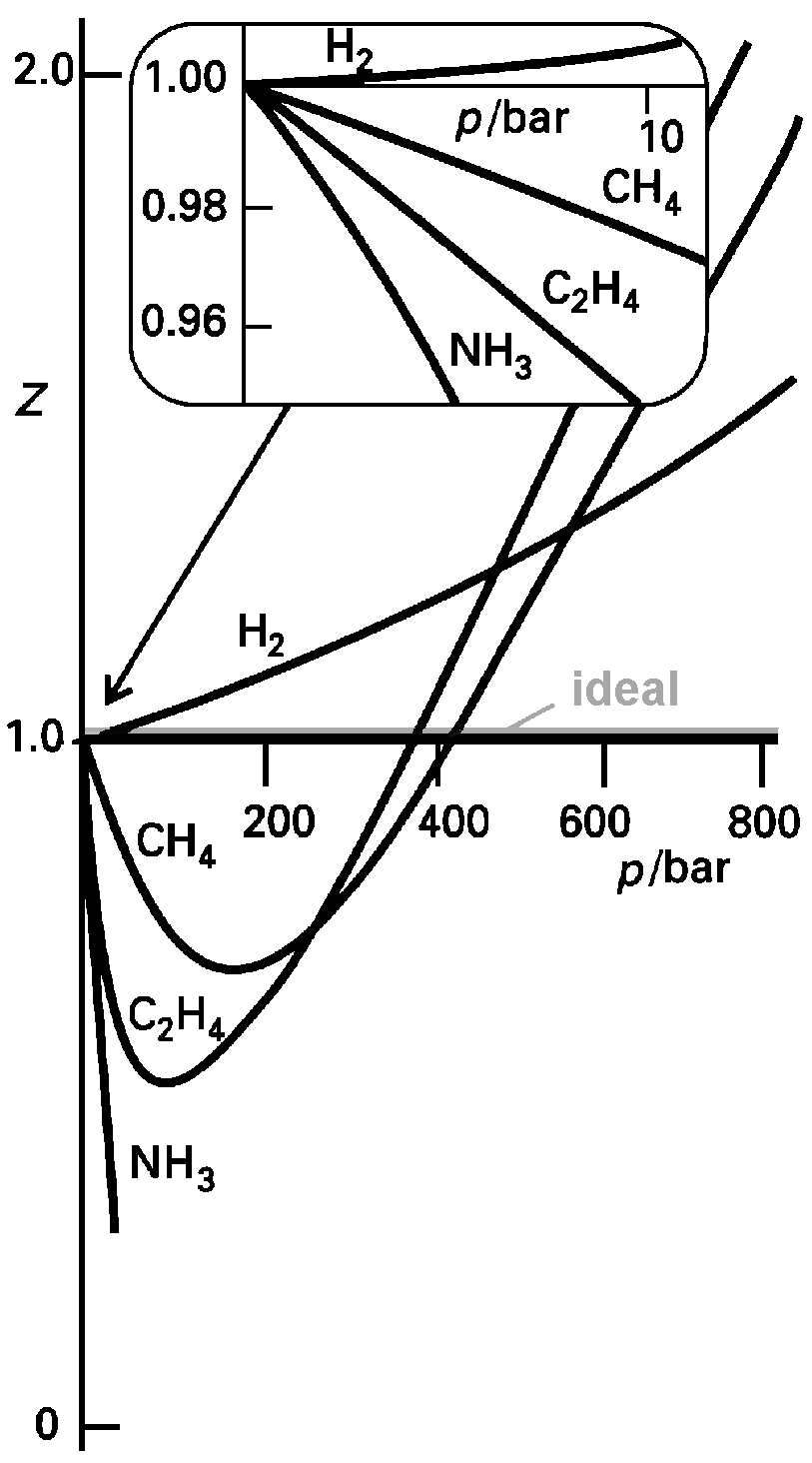 |
| Abb.
2: Die Variation des Kompressionsfaktors
Z = pVm / RT mit dem Druck für einige Gase bei 0°C. Für ein ideales Gas gilt bei beliebigem Druck Z = 1. Die Kurven nähern sich für p → 0 dem Wert 1 mit unterschiedlichen Steigungen. |
|
|
veranschaulichen. Für ein ideales Gas erhält man immer Z = 1; die Abweichung von 1 ist daher ein Maß für die Abweichung vom idealen Verhalten. Z wird in Abhängigkeit vom Druck aufgetragen. Die Abbildung zeigt einige experimentelle Werte von Z. Bei sehr kleinen Drücken verhalten sich die Gase nahezu ideal; Z ≈ 1; bei sehr hohen Drücken ist Z immer größer als 1, d.h. die Gase sind schwerer zu komprimieren als ein ideales Gas (pVm>RT). Es dominiert die Teilchenabstoßung. Bei mäßigem Druck ist für die meisten Gase Z < 1, d.h. die anziehende Kräfte sind bestimmend und das Gas ist vergleichsweise leicht komprimierbar.
![]()
Auf diesem Webangebot gilt die Datenschutzerklärung der TU Braunschweig mit Ausnahme der Abschnitte VI, VII und VIII.