Die von Johannes van der Waals 1873 vorgeschlagene Zustandsgleichung ist ein gutes Beispiel für sinnvolle, auf den physikalischen Inhalt gerichtete Vereinfachung eines komplizierten mathematischen Problems. Van der Waals leitete sie auf der Grundlage experimenteller Ergebnisse und exakter thermodynamischer Zusammenhänge ab.
Der Aufbau der Gleichung
Die Abstoßung zwischen den Molekülen wird berücksichtigt,
indem man die Teilchen als kleine harte Kugeln auffasst. Durch das
von Null verschiedene Eigenvolumen der Moleküle können diese
sich nicht im Gesamtvolumen V, sondern nur im Volumenanteil (V - nb) bewegen
(nb entspricht etwa der Summe der Eigenvolumina). Dies führt zum Ersatz
der Zustandsgleichung des idealen Gases, pV = nRT, durch
Der durch ein Gas auf die Gefäßwand ausgeübte Druck resultiert aus Stößen zwischen Gasteilchen und Wand. Durch zwischenmolekulare Anziehungskräfte reduzieren sich sowohl die Häufigkeit von Stößen als auch die dabei wirkenden Kräfte, und zwar in beiden Fällen proportional. Somit ist die Druckverminderung aufgrund solcher Anziehungskräfte proportional dem Quadrat der Konzentration und wird im Term a(n/V)2 gefasst, wobei a eine stoffspezifische positive Konstante ist. Über die angestellten Betrachtungen gelangt man zur van-der-Waalsschen Gleichung
|
|
|
|
| atm dm6/mol2 | dm3/mol | |
| ideal | 0.0 | 0.0 |
| He | 0.034 | 0.0237 |
| Ar | 1.345 | 0.0322 |
| O2 | 1.360 | 0.0318 |
| N2 | 1.390 | 0.0391 |
| CO2 | 3.592 | 0.0427 |
| CH4 | 2.253 | 0.0428 |
| H2 | 0.244 | 0.0266 |
|
|
Gewöhnlich schreibt man sie als Funktion des molaren Volumens Vm = V/n:
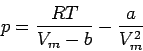
|
Wir wollen untersuchen, inwieweit das Verhalten realer Gase durch die Van-der Waalssche Gleichung adäquat wiedergegeben wird. Der Anspruch, mit einer einzigen, einfachen Gleichung alle möglichen Zustände aller Stoffe erfassen zu können, ist viel zu hoch. Der Vorteil der Van-der-Waalsschen Gleichung liegt darin, dass sie eine analytische Form hat und sich zum Ableiten einiger genereller Eigenschaften realer Gase eignet. Wenn diese Gleichung versagt, kann man eine andere Zustandsgleichung verwenden oder kommt zur Virialgleichung zurück.
Die van-der Waalssche Gleichung und die
Verflüssigung von Gasen
Die van-der-Waalssche Gleichung gibt das pVT-Verhalten von Gasen, die
nicht zu weit von der Idealität abweichen, recht genau wieder. Wenden
wir die Gleichung auf Gase in Zuständen an, die stark von der Idealität
abweichen, erhalten wir zwar keine quantitative Wiedergabe der Verhältnisse
mehr, immerhin jedoch noch ein interessantes qualitatives Bild. Ein typisches
Beispiel zeigt die Abbildung, in der die Van-der-Waalsschen Isothermen
(gestrichelte Linien) mit den experimentellen Isothermen für Kohlendioxid verglichen werden.
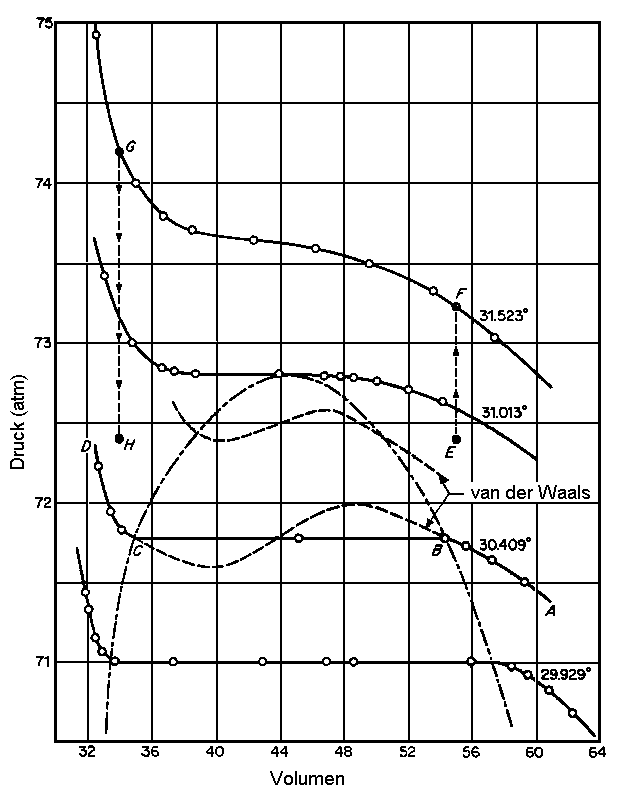 |
| Abb. 1: Isothermen des CO2 im kritischen Bereich. |
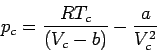 |
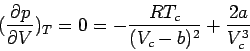 |
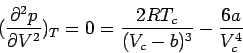 |
Bei der Auflösung dieser Gleichung für die kritischen Größen erhalten wir:
Wenn wir diese Ausdrücke nutzen, um reduzierte Zustandsvariablen pr, Vr und Tr in das Gleichungssystem einzusetzen, dann erhalten wir:
Die Van-der-Waalssche Gleichung erhält dann die folgende einfache Form:
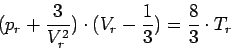 |
Unterhalb der kritischen Temperatur treten so genannte Van-der-Waals-Schleifen auf, die nicht das reale Verhalten wiedergeben, denn ihnen zufolge müsste in einem bestimmten Bereich eine Druckerhöhung zu einer Volumenvergrößerung führen. Sie wurden deshalb so durch horizontale Linien ersetzt, dass sich zwischen Kurve und Linie oberhalb und unterhalb der Verbindung gleiche Flächen ergeben, eine Methode, die von Maxwell eingeführt wurde. Durch Anpassung der berechneten Kurve an die experimentellen Daten mittels Regressionsrechnung erhält man die van-der-Waals-Koeffizienten.
Auf diesem Webangebot gilt die Datenschutzerklärung der TU Braunschweig mit Ausnahme der Abschnitte VI, VII und VIII.