Im Kapitel über Arbeit, insbesondere über Volumenarbeit, haben wir bereits kennengelernt, welche Arbeit ein Gas bei der Expansion gegen einen (konstanten) äußeren Druck leistet. Je nach den Bedingungen der Prozeßführung, d.h. wie der äußere Druck dem inneren Druck p angepaßt ist oder ob die Expansion isotherm, d.h. bei konstanter Temperatur T oder adiabatisch, d.h. bei konstanter Wärme q, erfolgt, sind die verrichtete Arbeit w, die Wärme q, die Temperaturänderung ΔT und die Änderung der Inneren Energie ΔU unterschiedlich.
Bei der isothermen Expansion gegen einen konstanten äußeren Druck, d.h. ΔT = 0, ist dU = 0, also dq = −dw. Für die Arbeit, die bei der Expansion gegen einen konstanten Druck geleistet wird, fanden wir bereits w = −paΔV und daher muss q = paΔV sein.
Bei der adiabatischen Expansion gegen einen konstanten äußeren Druck, d.h. dq = 0, ist dU = dw, also ΔU = Δw = −paΔV. Da ΔU = cV·ΔT, erhalten wir für die Temperaturänderung bei dieser Prozeßführung −paΔV = cV·ΔT oder für die Temperaturänderung:
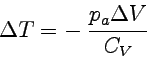 |
Bei der Expansion ist ΔV > 0 und daher ΔT < 0 !
Der wichtigste Spezialfall adiabatischer Volumenarbeit ist die reversible Expansion, bei der der äußere Druck in jedem Moment des Prozesses mit dem Innendruck des Systems übereinstimmt. Wenn sich nun das Volumen um dV ändert, beträgt die verrichtete Arbeit dw = -pdV. Mit dq = 0 (da adiabatisch) folgt daraus dU = -pdV. Da es sich um ein ideales Gas handeln soll, gilt außerdem dU = CV dT. dU ist ein totales Differential; daher müssen die rechten Seiten beider Ausdrücke gleich sein:
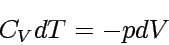 |
Durch die Volumenänderung ändert sich auch der Druck. Für ein ideales Gas erhalten wir (p = nRT/V):
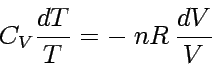 |
Bei Anstieg des Volumens von VA nach VE fällt die Temperatur von TA nach TE. Da wir die Temperaturabhängigkeit von CV vernachlässigen wollen (was für einatomige ideale Gase exakt ist, für mehratomige gilt es in guter Näherung), erhalten wir:
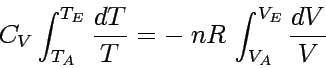 |
die Lösung lautet
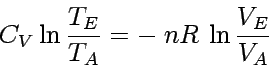 |
Wir schreiben nun c für 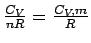 und stellen die Gleichung um, so dass sich ergibt
und stellen die Gleichung um, so dass sich ergibt
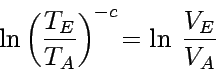 |
Anfangs- und Endtemperatur hängen also durch folgende Beziehung mit Anfangs- und Endvolumen zusammen:
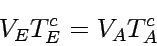 |
Die Temperaturänderung ist daher 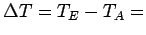
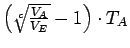
In der folgenden Tabelle ist das Verhalten eines Systems bei einer Reihe verschiedener möglicher Zustandsänderungen zusammengefaßt:
| Art der Arbeit | w | q | ΔU | ΔT |
| Expansion gegen pa = 0 | ||||
| isotherm | 0 | 0 | 0 | 0 |
| adiabatisch | 0 | 0 | 0 | 0 |
| Expansion gegen konstanten äußeren Druck | ||||
| isotherm | 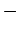 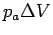 |
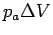 |
0 | 0 |
| adiabatisch | 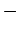 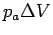 |
0 |  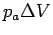 |
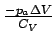 |
| reversible Expansion oder Kompression | ||||
| isotherm | 
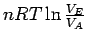 |
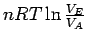 |
0 | 0 |
| adiabatisch | 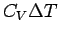 |
0 | 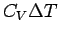 |
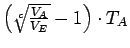 |
![]()
Auf diesem Webangebot gilt die Datenschutzerklärung der TU Braunschweig mit Ausnahme der Abschnitte VI, VII und VIII.