| Nach allgemeiner Erfahrung laufen in einem abgeschlossenen System so lange von selbst Prozesse ab, bis sich ein Gleichgewicht eingestellt hat. | |
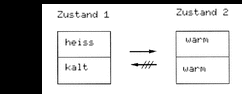 Abb. 1a Einstellung Temperaturgleichgewicht |
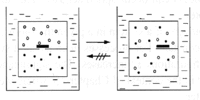 Abb. 1b Mischung von zwei Gasen |
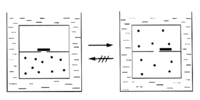 Abb. 1c Expansion eines Gases ins Vakuum |
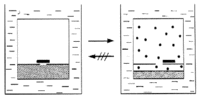 Abb. 1d Verdampfung einer Flüssigkeit ins Vakuum |
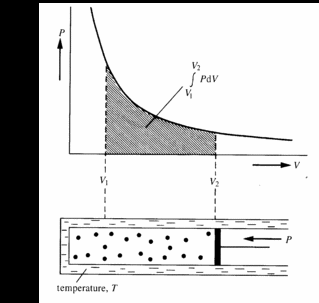 |
| Abb.2 pV-Diagramm für die Kompression eines idealen Gases von V1 nach V2 |
Wir wollen nun den Fall betrachten, daß der Stempel stoßartig zurückgezogen wird. Das Gas würde mit großer Geschwindigkeit in ein Vakuum diffundieren; hierbei würden in dem betrachteten Gesamtvolumen Druckdifferenzen und vielleicht sogar Turbulenzen auftreten. Unter solchen Bedingungen können wir natürlich den Zustand des Gases im gesamten System nicht mehr durch die zwei Variablen p und V wiedergeben. In Wirklichkeit würden wir eine enorme Zahl von Variablen benötigen, um die vielen unterschiedlichen Drücke an verschiedenen Punkten des Systems wiederzugeben. Eine solche Expansion ist ein typischer irreversibler Vorgang, die Zwischenzustände sind keine Gleichgewichtszustände mehr.
Thermodynamische und andere Vorgänge lassen sich in Wirklichkeit nie streng reversibel führen, da man sie hierzu unendlich langsam ablaufen lassen müßte. Alle natürlich ablaufenden Vorgänge sind daher irreversibel. Einem reversiblen Verlauf können wir uns nur annähern, indem wir einen irreversiblen Prozeß unter Bedingungen durchführen, die den Gleichgewichtsbedingungen nahekommen. Wir können aber einen reversiblen Verlauf genau definieren und dann die hierbei geleistete Arbeit berechnen, obwohl wir eine wirkliche Veränderung des Systems niemals reversibel durchführen können.
Der gezeigte Weg von V1 nach V2 ist nur einer von vielen. Diese Vielzahl von Möglichkeiten ergibt sich aus dem Umstand, daß sowohl das Volumen V als auch der Druck p eine Funktion der Temperatur T sind. Wählt man eine bestimmte Temperatur und hält sie während des ganzen Vorganges konstant, dann ist allerdings nur ein reversibler Weg möglich.
Unter solch einer isothermen Bedingung ist die beim reversiblen Übergang von A nach B am System verrichtete Arbeit die für die betreffende Temperatur überhaupt mögliche minimale Arbeit. Für einen reversiblen Vorgang hat also der Ausdruck Δw = -∫ pdV den größtmöglichen negativen Wert. Umgekehrt verrichtet das System beim reversiblen Übergang von V2 nach V1 die maximal mögliche Arbeit. Dies wird dadurch ermöglicht, daß die Ausdehnung des Systems gegen den maximal möglichen Außendruck erfolgt, der in jedem Augenblick gleich dem treibenden Innendruck ist.
Auf diesem Webangebot gilt die Datenschutzerklärung der TU Braunschweig mit Ausnahme der Abschnitte VI, VII und VIII.