Es wäre gut, wenn wir eine Temperaturänderung ΔT
als Folge einer Druckänderung Δp,
d.h. den Quotienten ΔT/Δp
, messen könnten.
Joule und William Thomson (der spätere Lord Kelvin) ließen
hierzu Gas durch ein Drosselventil von einer Seite konstanten Drucks zur
anderen strömen und registrierten die Temperaturdifferenz (Abb. 1).
Der ganze Apparat wurde isoliert, damit der Prozess adiabatisch ablief.
Sie beobachteten auf der Niederdruckseite eine niedrigere Temperatur, wobei
die Temperaturdifferenz der vorgegebenen Druckdifferenz proportional war.
Heutzutage sprechen wir vom Joule-Thomson-Effekt.
Thermodynamisch ist das Experiment wie folgt zu interpretieren: Das System arbeitet adiabatisch, deshalb ist dq = 0. Um die Arbeit zu berechnen, die geleistet wird, wenn das Gas durch die Drossel strömt, betrachten wir eine bestimmte Gasmenge, die von der Hochdruckseite (mit dem Druck pA, der Temperatur TA und dem Volumen VA) auf die Niederdruckseite (mit dem Druck pE, der Temperatur TE und dem Volumen VE) strömt. Gedanklich können wir uns einen Kolben vorstellen, den das weiter außen liegende Umgebungsgas bildet. Das Gas auf der linken Seite (Abb. 1) wird isotherm komprimiert, denn das zuströmende Gas wirkt wie ein Kolben. Der Druck, auf den es ankommt, ist pA; das Volumen ändert sich von VA auf 0.
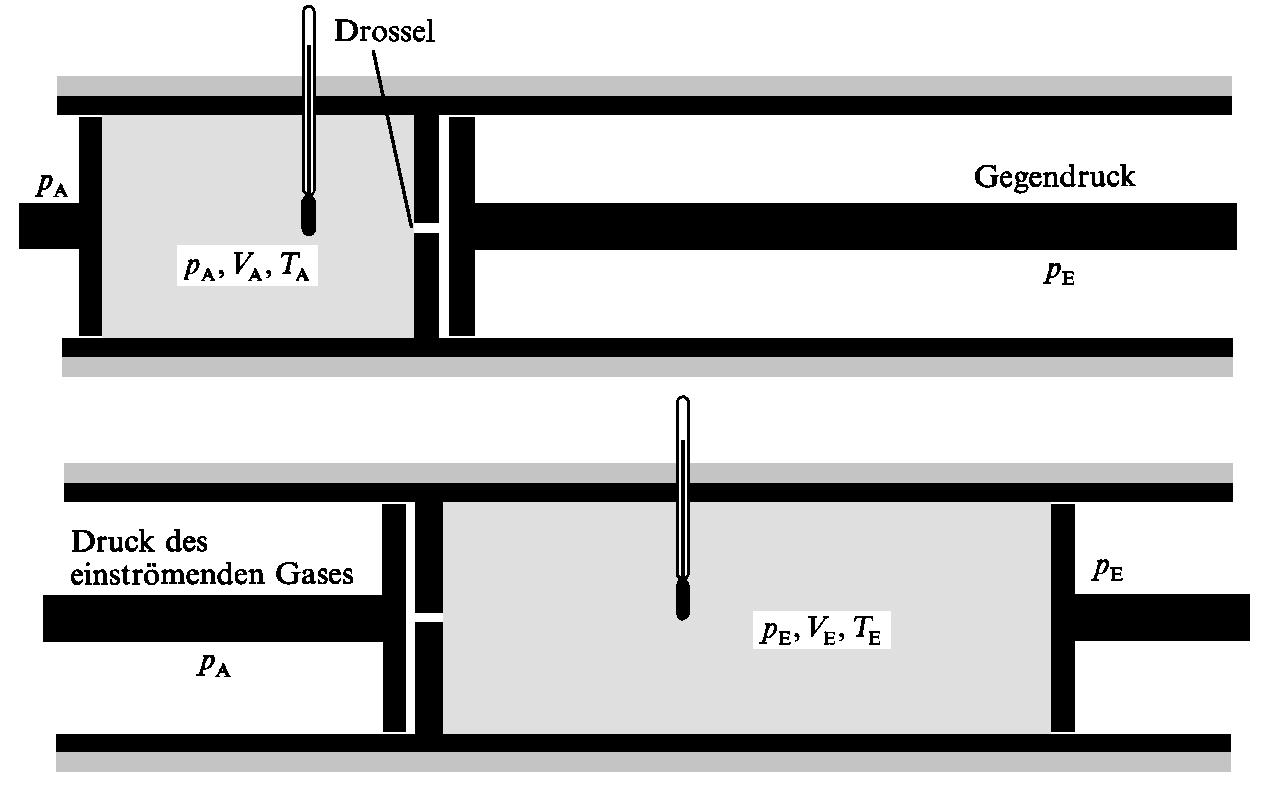 |
| Abb. 1: Darstellung der thermodynamischen Grundlagen der Joule-Thomson-Expansion. An der Stellung der Kolben ist das zu- bzw. ausströmende Gas erkennbar; die Kolben sorgen auf jeder Seite der Drossel für konstanten Druck. Der Übergang vom oberen zum unteren Diagramm, der dem Durchschnitt einer gegebenen Mange Gas durch die Drossel entspricht, erfolgt ohne Enthalpieänderung. |
µJT = (∂T/∂p)H.
Die Joule-Thomson-Koeffizienten von realen Gasen sind in der Regel von Null verschieden, auch wenn der Druck gegen Null geht. Das Vorzeichen des Koeffizienten kann positiv oder negativ sein. Ein positives Vorzeichen bedeutet, dass bei negativem Δp auch ΔT negativ sein muss, d.h. das Gas kühlt sich bei der Expansion ab. Vorzeichen und Zahlenwert von µJT hängen von der Natur des Gases und von den Messbedingungen ab. Mikroskopisch lässt sich der Joule-Thomson-Effekt besser so beschreiben: Verringert man den Druck auf ein Gas, etwa indem man es aus seinem Behälter herausströmen lässt, expandiert es. Das heißt, das vom Gas eingenommene Volumen nimmt zu. Dabei nimmt auch der mittlere Teilchenabstand zu. Bei realen Gasen wirken dabei anziehende oder abstoßende Kräfte zwischen den Teilchen, wobei in den meisten Fällen, wie etwa bei den Gasen der Luft bei Normaldruck, die anziehenden Kräfte vorherrschend sind. Wenn der mittlere Teilchenabstand zunimmt wird Arbeit gegen die Anziehungskräfte, die zwischen den Teilchen wirken, verrichtet. Die Energie dazu kommt aus der kinetischen Energie des Gases, die dadurch verringert wird. Die Teilchen werden im Mittel langsamer und das Gas kühlt in der Folge ab. Ein ideales Gas zeigt keinen Joule-Thomson-Effekt, da zwischen seinen Teilchen keine Wechselwirkungen auftreten.
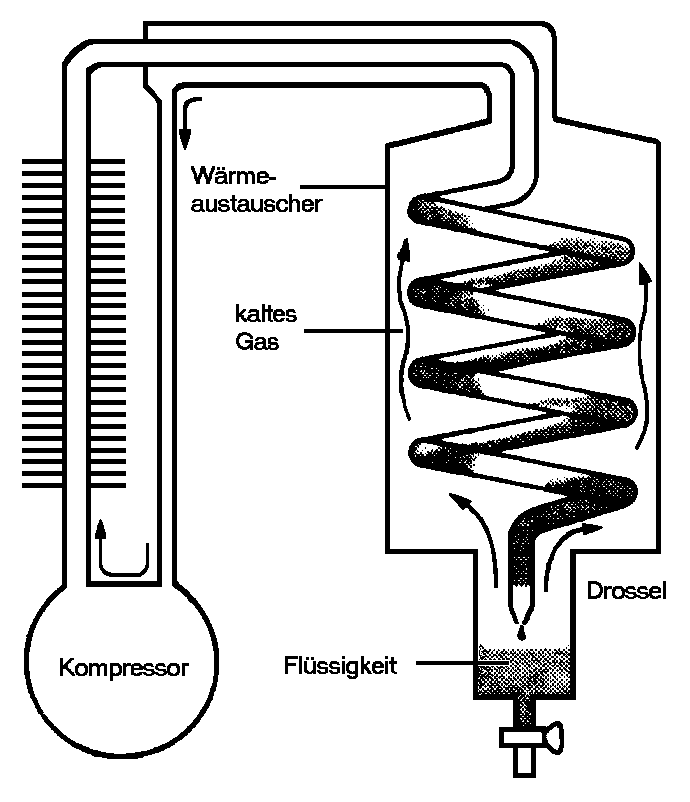 |
| Abb. 2: Hier ist das Prinzip der Linde-Kältemaschine wiedergegeben. Das Gas fließt in einem geschlossenem Kreislauf (allerdings wird nach der Kompression das Gas an die Umgebungstemperatur angepaßt), und solange seine Temperatur unterhalb der Inversionstemperatur liegt, kühlt es sich ab, wenn es durch die Drossel expandiert. Das kalte Gas dient zur Kühlung des unter Druck stehenden Gases vor der Drossel, das sich dann bei der Expansion noch weiter abkühlt. Verflüssigt sich das Gas, so entstehen Topfen in der Nähe der Drossel. |
Der Joule-Thomsom-Effekt hat eine technische Bedeutung bei Kühlen und Verflüssigen von Gasen. Die Kältemaschine von Linde beruht auf dem Prinzip, dass sich ein Gas für µJT > 0 beim Ausdehnen abkühlt. Das Prinzip der Kältemaschine von Linde zeigt Abb. 2: Wenn das Kühlgas im Kreislauf geführt wird und wenn der Druckabfall an der Drossel genügend groß ist, so fällt die Temperatur unter die Kondensationstemperatur, und das Gas verflüssigt sich. Manche Gase für die µJT< 0 ist müssen zuerst mit anderen Gasen vorgekühlt werden. Würde man z.B. Helium bei Zimmertemperatur benützen, so würde aus der Kältemaschine lediglich ein teurer Ofen.
Für perfekte Gase gilt µJT = 0; bei ihnen ändert
sich also die Temperatur im Joule-Thomson-Experiment nicht.
![]()
Auf diesem Webangebot gilt die Datenschutzerklärung der TU Braunschweig mit Ausnahme der Abschnitte VI, VII und VIII.