Nehmen wir an, ein Gas befindet sich in einem durch einen Kolben geschlossenen Behälter; der äußere Druck pa sei gleich dem Druck p des eingeschlossenen Gases. Dieses System befindet sich im mechanischen Gleichgewicht mit seiner Umgebung; eine infinitesimale Änderung des äußeren Drucks in jeder möglichen Richtung ruft eine Volumenänderung des Systems hervor. Unter diesen Umständen nähert sich der Vorgang im Kolben der reversiblen Prozessführung. Diese stellt eine Idealisierung dar, die es streng genommen nicht gibt, denn wenn sich ein System im Gleichgewicht befindet, so haben die Zustandsvariablen zeitunabhängige Werte und es passiert makroskopisch nichts.
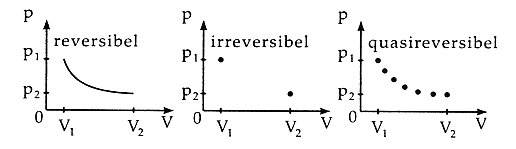 Durch kleine schrittweise Änderungen lassen sich die Abweichungen zwischen Theorie und Praxis verkleinern, ein Prozess wird quasireversibel geführt. Durch kleine schrittweise Änderungen lassen sich die Abweichungen zwischen Theorie und Praxis verkleinern, ein Prozess wird quasireversibel geführt. |
Ansatz für die Herleitung der Volumenarbeit eines Gases bei reversibler Expansion ist, da pa idealerweise gleich p ist:
Die gesamte bei einer reversiblen Expansion geleistete Arbeit ist dann
Wenn wir die physikalische Beziehung zwischen Druck und Volumen des eingeschlossenen Gases kennen, können wir dieses Integral auswerten.
Wir betrachten die isotherme reversible Volumenänderung eines idealen Gases: Der isotherme Charakter des Prozesses ist gewährleistet, wenn wir dem System einen ständigen Wärmeaustausch mit seiner Umgebung gestatten (z.B. durch ein Wasserbad, einen Thermostaten): Also muss in jedem Stadium des Prozesses gelten p = nRT/V. V ist dabei das Volumen im jeweiligen Moment der Zustandsänderung. Da der Prozess isotherm verlaufen soll, ist die Temperatur T konstant und kann gemeinsam mit den ebenfalls konstanten Größen n und R vor das Integral gezogen werden. Damit erhält man für die Arbeit bei reversibler isothermer Volumenänderung eines idealen Gases vom Volumen VA nach VE bei der Temperatur T
Ist das Endvolumen der Rechnung größer als das Ausgangsvolumen, dann ist der Logarithmus positiv, und es ergibt sich w < 0. In diesem Fall hat das System Arbeit an der Umgebung verrichtet - seine Innere Energie ist daher gesunken. Der Gleichung kann man weiterhin entnehmen, dass die für eine bestimmte Volumenänderung aufzuwendende Arbeit mit der Temperatur des Systems steigt.
 |
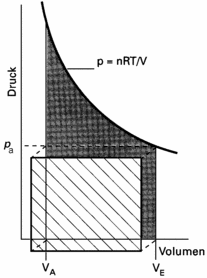 |
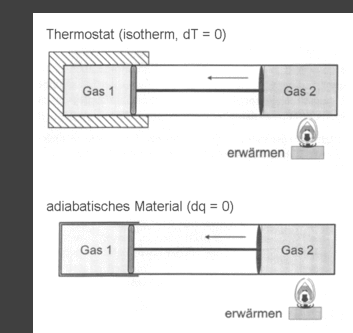
| Abb. 1: Anordnung zur reversiblen isothermen Kompression eines Gases im Zylinder 1 durch Erwärmen eines anderen Gases das sich in Zylinder 2 befindet (oberes Bild), wobei sich der Zylinder in einem Wärmebad konstantet Temperatur befindet. Werden die Wände des Zylinders 1 perfekt isoliert (adiabatisches Material) dann erfolgt adiabatische Kompression. | Abb. 2: Die von einem idealen Gas bei reversibler, isothermer Expansion verrichtete Arbeit ist äquivalent der dunklen Fläche unter der Isotherme. Für den Fall, dass die Expansion irreversibel gegen den Enddruck pa stattfindet, entspricht die verrichtete Arbeit dem schraffierten Rechteck. Der Betrag der reversiblen Arbeit ist größer als der der irreversiblen. |
Das Ergebnis der Rechnung lässt sich anhand des Diagramms in Abb. 2 veranschaulichen. Der Betrag der Arbeit ist gleich der Fläche unter der Isotherme p = nRT/V. Im Diagramm hervorgehoben ist die Rechteckfläche, die man für eine irreversible Expansion gegen einen konstanten äußeren Druck erhält, dessen Wert dem Endwert bei der reversiblen Expansion entspricht. Der Betrag der Arbeit (d.h. die Fläche unter der Kurve) ist im Fall des reversiblen Prozesses größer.
| Den größtmöglichen Betrag an Volumenarbeit, den man bei einer gegebenen Zustandsänderung des Systems gewinnen kann, erhält man bei einem reversiblen Übergang vom Ausgangs- in den Endzustand. |
![]()
Auf diesem Webangebot gilt die Datenschutzerklärung der TU Braunschweig mit Ausnahme der Abschnitte VI, VII und VIII.