Temperaturabhängigkeit (Gibbs-Helmholtz-Gleichung)
Weil (∂G/∂T)p = −S und S positiv ist, folgt dass bei einer Temperaturerhöhung (bei konstantem Druck und konstanter Zusammensetzung) G abnimmt. Diese Abnahme ist besonders stark, wenn die Enthalpie des Zustandes hoch ist. Aus diesem Grunde ist die Freie Enthalpie von Gasen wesentlich stärker von der Temperatur abhängig als die Freie Enthalpie von Flüssigkeiten und Festkörpern.
Die so beschriebene Temperaturabhängigkeit kann man auch mit Hilfe der Enthalpie (anstelle der Entropie) formulieren. Wir ersetzen dazu in der obigen Gleichung S durch S = (H - G)/T, was aus der Definitionsgleichung für G (G=H-TS) folgt:
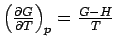 oder
oder 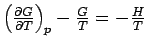 .
.Das läßt sich weiter zur Gibbs-Helmholtz-Gleichung umordnen:
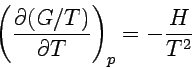 |
Diese Gleichung liefert uns die Temperaturabhängigkeit von G/T, wenn wir die Enthalpie eínes Systems kennen (die Identität mit der Ausgangsgleichung sieht man sofort durch differenzieren von G/T).
Die Gibbs-Helmholtz-Gleichung ist vor allem bei Änderung des physikalischen Zustandes und bei chemischen Reaktionen von Nutzen. Wenn wir für die Differenz der Freien Enthalpie zwischen einem End- und einem Ausgangszustand ΔG = GE - GA schreiben und die Gibbs-Helmholtz-Gleichung auf GE und GA anwenden, so erhalten wir
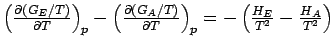 .
.Mit ΔH = HE − HA ergibt das
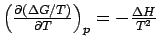 .
.Die Größe ΔG/T eignet sich ausgezeichnet
zur Behandlung des chemischen Gleichgewichts.
Druckabhängigkeit der Freien Enthalpie
Die Druckabhängigkeit der Freien Enthalpie können wir über (∂G/∂p)T = V bestimmen, wenn wir das Volumen des Systems kennen. Weil V positiv ist, nimmt G bei einer Druckerhöhung immer zu. Durch Integration dieser Gleichung erhält man explizit die Freie Enthalpie bei einem bestimmten Druck p in Abhängigkeit von ihren Wert bei einem anderen Druck p°:
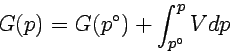 |
Bei Flüssigkeiten oder Festkörpern ändert sich das Volumen nur wenig, wenn man den Druck variiert; man kann deshalb V praktisch als konstant ansehen und vor das Integral ziehen. Für molare Größen lautet die Gleichung dann
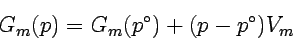 |
Unter normalen Laborbedingungen ist (p − p°)Vm sehr klein und darf vernachlässigt werden:
für Flüssigkeiten und Festkörper gilt
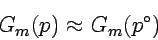 |
Falls wir uns aber mit geophysikalischen Fragestellungen beschäftigen,
dann darf wegen des hohen Drucks im Erdinnern die Druckabhängigkeit
der Freien Enthalpie nicht mehr vernachlässigt werden.
Bei Gasen hängt das Volumen sehr stark vom Druck ab und wir können
es bei der Integration nicht als konstant ansehen. Für ideale Gase
ist V = nRT / p und wir erhalten
nach Integration p°∫pp-1dp = ln p - ln p°:
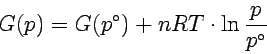 |
![]()
Auf diesem Webangebot gilt die Datenschutzerklärung der TU Braunschweig mit Ausnahme der Abschnitte VI, VII und VIII.