Wir können die Entropie eines Systems bei einer beliebigen Temperatur TE bzw. einem beliebigen Volumen VE berechnen; Voraussetzung ist, dass die Entropie für eine andere Temperatur TA bzw. einem anderen Volumen VA bekannt ist.
Für die Innere Energie gilt dU = dq + dw = dq - pdV. Mit dq = TdS und dU = CVdT erhalten wir CVdT = TdS - pdV. Daraus folgt:
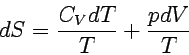 |
oder
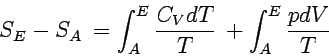 |
Betrachten wir zunächst die Entropieänderung eines idealen
Gases (bzgl. einer Volumenänderung) bei konstanter Temperatur (dT = 0):
Für das ideale Gas ist p/T = nR/V und die Entropieänderung
ergibt sich zu:
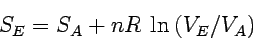 |
Für die Entropieänderung bei konstantem Volumen erhalten wir bzgl. einer Temperaturänderung allgemein:
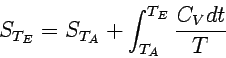 |
Mit Hilfe dieser Beziehungen können wir die Entropie eines Stoffes bei jeder gewünschten Temperatur berechnen, vorausgesetzt, die Wärmekapazität wurde im betrachteten Temperaturbereich experimentell bestimmt.
Insbesondere wollen wir den Fall betrachten, dass das System unter konstantem Druck erwärmt wird. Aus der Definition der Wärmekapazität erhalten wir dann
dqrev = CpdT = TdS,
wenn das System keine Expansionsarbeit verichtet. Folglich ist bei konstantem Druck
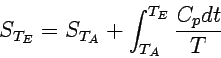 |
Für den Fall, dass Cp bzw. CV im interessierenden Intervall nicht von der Temperatur abhängen, erhalten wir nach Integration:
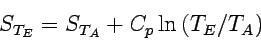
|
![]()
Auf diesem Webangebot gilt die Datenschutzerklärung der TU Braunschweig mit Ausnahme der Abschnitte VI, VII und VIII.