Das Phasendiagramm eines Stoffes ist eine graphische Darstellung der Druck- und Temperaturbereiche, in denen die einzelnen Phasen thermodynamisch stabil sind (siehe Abbildung unten). Die Bereiche werden durch Phasengrenzlinien voneinander getrennt; diese repräsentieren Wertepaare (p,T), bei denen zwei Phasen miteinander im Gleichgewicht stehen.
Betrachten wir einen reinen Stoff, der sich in einem geschlossenen Behälter mit konstanten Volumen befindet. Der Druck der Gasphase, die sich mit der kondensierten Phase im Gleichgewicht befindet, ist der Dampfdruck dieses Stoffes bei der gegebenen Temperatur.
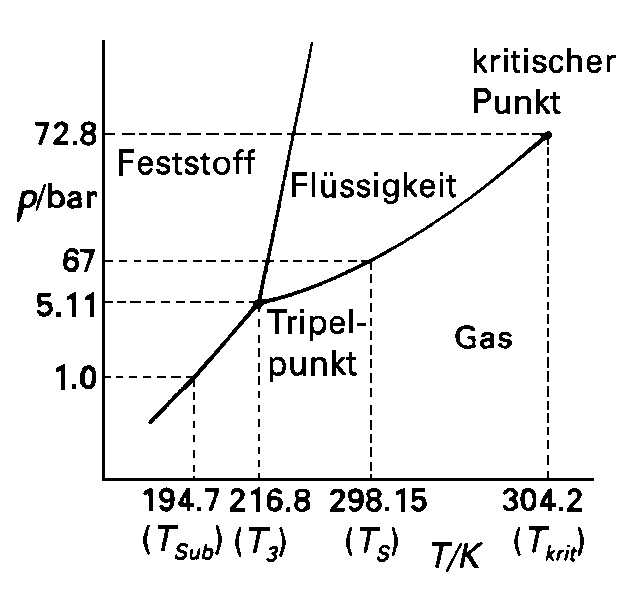 |
| Abb. 1: Das experimentell bestimmte Phasendiagramm von Kohlendioxid gibt an, wo gasförmige, flüssige und feste Phase am stabilsten sind, d.h. das niedrigste chemische Potential aufweisen. beim Kohlendioxid ist der Druck am Tripelpunkt wesentlich größer als der Atmosphärendruck. Unter normalen Bedingungen existiert daher kein flüssiges CO2. |
Bei bestimmten (p,T)-Werten können auch drei Phasen (meist fester, flüssiger und gasförmiger Aggregatzustand) eines Stoffes koexistieren. In diesem Tripelpunkt schneiden sich drei Phasengrenzlinien (in der Abbildung ist der Punkt markiert, die zugehörige Temperaturr bezeichnen wir mit T3). Die Lage des Tripelpunktes ist nicht beeinflußbar; für jeden Stoff existiert ein einziges charakteristisches Wertepaar (Druck, Temperatur). Der Tripelpunkt von Wasser liegt bei 273,16 K und 611 Pa; an keinem anderen Punkt können die drei Phasen Eis, flüssiges Wasser und Wasserdampf im Gleichgewicht koexistieren. Diese Invarianz des Tripelpunktes nutzt man zur Definition der thermodynamischen Temperaturskala aus.
Die Abbildung zeigt das Phasendiagramm von Kohlendioxid. Die Phasengrenzlinie fest/flüssig weist (wie bei den meisten Substanzen außer Wasser) eine positive Steigung auf - das bedeutet, dass die Schmelztemperatur von Kohlendioxid mit zunehmendem Druck ansteigt. Der Tripelpunkt liegt oberhalb des Atmosphärendruckes. Daher kann eine flüssige Phase des CO2 unter diesem Druck bei keiner Temperatur existieren, so dass der Feststoff sublimiert (daher auch der Name "Trockeneis"). Zur Erzeugung der flüssigen Phase muss ein Druck von mindestens 0,52 MPa ausgeübt werden. CO2-Druckgasflaschen enthalten flüssiges CO2 beziehungsweise komprimiertes Gas; wenn Gas und Flüssigkeit im Gleichgewicht vorliegen, beträgt der Dampfdruck bei 25°C immerhin 6,8 MPa. bei Ausströmen durch das Ventil kühlt sich das Gas infolge des Joule-Thompson-Effekts ab. Wenn der äußere Druck etwa 0,1 MPa (1 bar) beträgt, kondensiert es dabei sofort zu einem feinverteilten, schneeähnlichen Feststoff. Dies wird häufig genutzt, um kleinere Mengen von Trockeneis im Labor herzustellen
![]()
Auf diesem Webangebot gilt die Datenschutzerklärung der TU Braunschweig mit Ausnahme der Abschnitte VI, VII und VIII.