von Florian Friedlein, Didaktik der Chemie, Universität
Bayreuth


1.
Überblick über Säure-Base-Konzepte
1.1.
Arrhenius
Bereits im 17. Jahrhundert versuchte sich Robert Boyle
in einer Säure-Definition, mehrere Chemiker wie bspw. Lavoisier schlossen
sich an. Doch die erste korrekte und bedeutende Definition konnte 1887
von Svante Arrhenius formuliert werden. Er definierte:
|
Säuren sind Verbindungen, die in Wasser durch
Dissoziation Wasserstoffionen bilden. Basen werden als Substanzen beschrieben,
die bei ihrer Ionisation in Wasser Hydroxidionen bilden.
|
Arrhenius erkannte, dass die sauren Eigenschaften
einer Lösung durch H+ -Ionen, die basischen durch OH-
-Ionen zustande kommen. Vereinigt man eine Säure mit einer Base entsteht
eine Lösung, die weder basisch noch sauer reagiert. Es bildet sich
eine neutrale Lösung, die sich wie eine entsprechende Salzlösung
verhält, der Vorgang wird Neutralisation genannt.
1.2.
Brönsted und Lowry
Im Jahre 1923 publizierten der Schwede Brönsted
und der Engländer Lowry unabhängig voneinander ihre Konzepte.
Hierin erweiterten sie das Konzept von Arrhenius dahingehend, dass
sie Säuren als Protonen-Donatoren und Basen als Protonen-Akzeptoren
definierten. So ist HCl eine Säure, da sie Protonen abspalten kann.
Erfolgt diese Reaktion, so entsteht das Chloridion. Dies ist eine Base,
da es Protonen aufnehmen kann. Teilchen, die sich also nur durch den Grad
der Protonierung unterscheiden, nennt man korrespondierende bzw. konjugierte
Säure-Base-Paare.
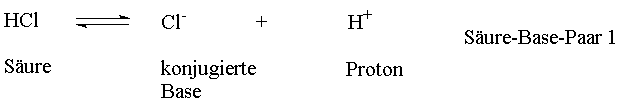
Allerdings geht die Abspaltung eines Protons niemals
in einer isolierten Reaktion vor sich. Es muss immer eine zweite Reaktion
gekoppelt sein, damit das Proton aufgenommen wird. Protonen existieren
nicht frei in gewöhnlicher Materie. In Wasser kann die Reaktion ablaufen,
da sich das Proton an ein H2O-Molekül anlagert, was hier
als Base wirkt. Es entsteht dabei die Säure H3O+.
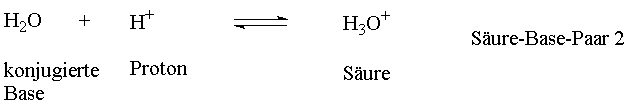
Fasst
man die beiden Teilreaktionen zu einer Gesamtreaktion zusammen, so erhält
man:
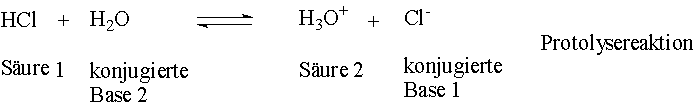
An einer Protolysereaktion (Protonenübertragungsreaktion)
sind also immer zwei Säure-Base-Paare beteiligt, zwischen denen ein
Gleichgewicht existiert. Je nachdem, ob das Gleichgewicht mehr auf der
linken bzw. rechten Seite liegt, ist Säure 1 eine schwache bzw. starke
Säure (in Wasser). Über das Massenwirkungsgesetz kann nun die
Säurekonstante KS ermittelt werden, wobei man meist den negativen
dekadische Logarithmus der Säurekonstanten als Richtwert benutzt.
Damit lässt sich schön eine Quantifizierung aller Brönsted-Säuren
vornehmen.
Im Vergleich zur Definition nach Arrhenius sind die
Säuren und Basen keine fixierten Stoffklassen, sondern nach ihrer
Funktion definiert. So sind nicht nur Metallhydroxide Basen sondern bspw.
auch NH3, CO32- und das S2-.
Ampholyte können je nachdem ob sie Protonen aufnehmen oder abgeben,
entweder als Säuren oder Basen wirken (H2O, HSO4-).
1.3.
Lux und Flood
Bei der von Lux 1939 vorgeschlagenen und von Flood 1947
erweiterten Definition steht als wesentlicher Reaktant einer Säure-Base-Reaktion
nicht mehr das Proton, sondern das Oxidion. Dieses Konzept wurde entwickelt,
weil das Brönsted-Lowry-Konzept nicht für protonenfreie Systeme
angewendet werden kann. In anorganische Schmelzen findet beispielsweise
folgende Reaktion statt:
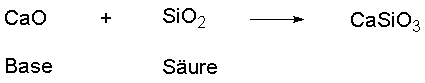
Die Base CaO ist ein Oxid-Ionen-Donator, die Säure
SiO2 ein Oxid-Ionen-Akzeptor. Diese Definition ist allerdings
auf solche Systeme wie geschmolzene Oxide beschränkt Im Mittelpunkt
dieser Betrachtungsweise stehen die Anhydride der jeweiligen Säuren
und Basen. Die Lux-Flood-Base ist ein Basenanhydrid, die im Wasser folgendermaßen
reagiert:
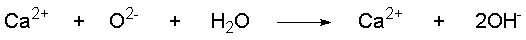
Die Lux-Flood-Säure ist ein Säureanhydrid,
die im Wasser wie folgt reagiert:
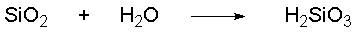
1.4.
Lösemittel als Säure-Base-Systeme
Viele Lösungsmittel zeigen ebenso wie Wasser eine
Eigendissoziation unter Bildung eines Kations und eines Anions. Nun lässt
sich folgende Definition aufstellen:
|
Eine Säure ist eine Substanz, die die
Konzentration des für das Solvens charakteristische Kations erhöht;
eine Base ist eine Substanz, die die Konzentration des charakteristischen
Anions erhöht.
|
Beispielsweise kann deshalb PCl5 (Phosphorpentachlorid)
im Lösungsmittelsystem Phosphorchloridoxid als Säure definiert
werden.

Vorteil dieser Betrachtungsweise ist, dass man derartige
nichtwässrige Lösungsmittel in der gleichen Form behandeln kann
wie Wasser. Analog der pH-Skala lassen sich Neutralpunkte konstruieren
und Säurestärken quantifizieren.
1.5.
Lewis
Das Säure-Base-Konzept von G. N. Lewis ist stellt
noch einmal eine Verallgemeinerung gegenüber dem Brönsted-Konzept
dar. Lewis definierte "seine" Lewis-Säuren und Lewis-Basen folgendermaßen:
Teilchen mit unbesetzten Orbitalen in der Valenzelektronenschale,
die unter Bildung einer kovalenten Bindung ein Elektronenpaar aufnehmen
können (Elektronenpaarakzeptoren) werden als Lewis-Säuren bezeichnet.
Lewis-Basen sind dagegen Teilchen, die ein freies Elektronenpaar besitzen,
das zur Ausbildung einer kovalenten Bindung geeignet ist (Elektronenpaardonatoren).
|
Die Definition von Lewis umfasst zusätzlich
zu den bisher behandelten Reaktionen auch Umsetzungen, bei denen keine
Ionen entstehen und keine Wasserstoff-Ionen oder andere Ionen übertragen
werden.
So schließt die Definition von Lewis alle Reaktionen,
zu denen Wechselwirkungen mit Wasserstoffionen, mit Sauerstoffionen oder
mit dem Lösungsmittel gehören, ebenso ein wie die Bildung von
Säure-Base-Addukten wie R3N-BF3 oder Koordinationsverbindungen.
1.6.
Usanovich
Leider schrieb Usanovich 1939 seine Säure-Base-Definition
nur auf russisch, was ein Grund dafür sein könnte, dass sie sich
nicht durchsetzen konnte. Usanovichs Definition umfasst alle Lewis-Säure-Base-Reaktionen
und erweitert das Lewis-Konzept dadurch, dass es die Aufnahme und Abgabe
nicht nur auf gemeinsame Paare beschränkt. Seine Definition lautet:
Eine Säure ist jede chemische Verbindung,
die mit Basen reagiert, Kationen abgibt oder Anionen bzw. Elektronen aufnimmt.
Entsprechend ist eine Base jede Verbindung, die mit Säuren reagiert,
Anionen oder Elektronen abgibt oder sich mit Kationen vereinigt.
|
Man merkt an dieser Definition sehr schnell, dass
neben den Säure-Base-Reaktionen nach Lewis auch die Redoxreaktionen
mit einbezieht. Hier liegt auch der große Kritikpunkt - der Begriff
"Säure-Base-Reaktion" wird unnötig, der Begriff "Reaktion" reicht
völlig aus.
2.
Harte und weiche Säuren und Basen - das HSAB-Prinzip
"Harte Säuren verbinden sich bevorzugt mit
harten Basen; weiche Säuren verbinden sich bevorzugt mit weichen Basen"
|
Wie kam Pearson auf dieses allgemeine Konzept? Es
wurde versucht - wie für Brönsted-Säuren und -Basen die
Säurekonstanten bzw. Basenkonstanten - eine Quantifizierung der Stärke
zu erlangen.
2.1. Stabilitätsreihe
von Irving und Williams
Anhand von Tendenzen in den Stabilitäten von Metallkomplexen
bei verschiedenen Liganden merkte man, dass eine Quantifizierung der Säure-
bzw. Basenstärke nicht ausreichte. Es musste ein qualitativer Faktor
eingeführt werden. Man teilte deshalb Säuren und Basen in die
Klassen a und b ein. So zeigten bspw. die Metallionen der Klasse a eine
höhere Affinität zur Bildung eines Lewis-Säure-Base-Adduktes
mit den Liganden der Klasse a und umgekehrt.
|
Metallionen
|
|
Klasse a
|
Klasse b
|
|
H+, Alkali- und Erdalkalimetalle,
leichte Übergangsmetalle in höheren Oxidationsstufen wie Ti4+,
Cr3+, Fe3+ und Co3+
|
Ionen der schweren Übergangsmetalle in
niedrigen Ox.-stufen wie Cu+, Ag+, Hg+,
Hg2+, Pd2+ und Pt2+
|
|
Liganden
|
|
Klasse a
|
Klasse b
|
|
N >> P > As > Sb
O >> S > Se > Te
F > Cl > Br > I
O > N > S
|
N << P >
As > Sb
O << S < Se
= Te
F < Cl < Br < I
S < N < O
|
2.2. Gleichgewichtskonstante
für das System
Eine genauere Einteilung konnte anhand der folgenden
Reaktionsgleichung durchgeführt werden. Je nach Verschiebung der Gleichgewichtskonstanten
konnte eine qualitative Klassifizierung der jeweiligen Base getroffen werden.
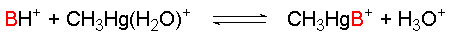
(B steht hier für Base, und nicht für Bor!!)
Die Begriffe "hart" und "weich" wurden von Pearson geprägt, um die
zu den Klassen a und b gehörenden Substanzen zu beschreiben. So klassifizierte
er alle Lewis-Säuren und -Basen in hart oder weich.
Lewissäuren:
| Hart |
Grenzbereich |
Weich |
| H+,
Li+, Na+, K+, Be2+
Mg2+, Ca2+, Al3+,
Fe3+
Cr3+, Ti4+, SO3,
BF3 |
Fe2+,
Co2+, Ni2+, Cu2+
Pb2+, Zn2+, Sn2+,
SO2 |
Pd2+,
Pt2+,Cu+, Ag+
Au+, Hg+, Hg2+,
Tl+
Cd2+, BH3 |
Lewisbasen:
| Hart |
Grenzbereich |
Weich |
| F-,
OH-, O2-, ClO4-
SO42-, NO-3,
PO43-, CO32-
H2O, NH3 |
Br-,
NO2-, SO32-,
N3-, N2
|
H-,
I-, CN-, SCN-, S2-
S2O32-,
CO, C6H6 |
2.3. Eigenschaften,
die die Härte oder Weicheit von Lewis-Säuren und Lewis-Basen
bestimmen:
Eine Lewis-Säure ist umso härter,
je
 |
kleiner sie
ist (weniger polarisierbar) H+ > Li+
> Na+ > K+ |
 |
höhere
Ladung, Fe3+ > Fe2+, Al3+, Ti4+ |
 |
höhere
Oxidationsstufe, Ni(IV) > Ni(II) > Ni(0) |
 |
höhere
Elektronegativität und weniger d-Elektronen sie hat, Li+
> Cu+* |
 |
härtere
Substituenten BF3 > BH3 sie hat. |
|
*Vorsicht! Man betrachtet Ionen! Das zweite
Ionisierungspotential von Li+ ist sehr hoch - viel höher
als das vom Übergangsmetallion Cu+. D.h. auch die Elektronegativität
des Lithium-Ions ist höher als das des Cu+-Ions. Die Elektronegativität
nimmt zwar ausgehend vom Ca2+-Ion zum Zn2+-Ion zu
(und die Ionen müssten somit härter werden), tatsächlich
werden die Ionen aber weicher. Grund dafür ist die Zunahme der d-Elektronen.
Das saure Bor-Atom ("B3+"), das zwischen
hart und weich liegt, wird durch die harten Fluorid-Ionen viel härter.
Entsprechend wird es durch weiche Hydrid-Ionen viel weicher. Die Tendenz
solcher Verbindungen, jeweils lieber entsprechende Basen anzulagern (BF3
hat höhere Affinität zu F-, BH3 höhere
Affinität zu H-) wird als "Symbiose" bezeichnet.
Eine Lewis-Base ist umso härter, je
 |
kleiner (weniger
polarisierbar) sie ist F- > Cl- > Br-
> I- |
 |
höhere
Elektronegativität F- > OH- > NH2-
> CH3- |
 |
höhere
Oxidationsstufe SO32- > S2- |
 |
härtere
Substituenten sie hat NH3 > Pyridin |
|
2.4. Hinweise bei
der Anwendung des Pearson-Prinzips:
 |
Wenn man sich
nun die Angaben in den Tabellen betrachtet, muss klar sein, dass die Begriffe
"hart" und "weich" relativ sind und es keine scharfe Trennungslinie gibt.
Dies wird klar durch die dritte Kategorie "Grenzbereich". Aber auch innerhalb
einer Gruppe sind nicht alle Verbindungen gleich hart oder weich. |
 |
Beziehung
zwischen der Stärke von Säuren und Basen und ihrer Härte
bzw. Weichheit: Man darf neben den Begriffen hart und weich nicht vergessen,
dass jede Säure oder Base auch noch ihre eigene Säuren- oder
Basenstärke besitzt. So sind z.B. F- und OH-
beide harte Basen, aber die Basizität des Hydroxidions ist 10 13
mal so stark! Das Sulfition ist im Gegensatz zum harten Fluoridion
eine weichere, aber stärkere Base, welche das Fluorid vom harten Proton
verdrängen kann: |
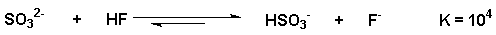
In diesem Fall reicht die Stärke der Base (SO3-
> F-) aus, die Reaktion nach rechts ablaufen zu lassen - unabhängig,
ob ein "hart-hartes" Säure-Base-Paar getrennt wird und ein "hart-weiches"
entsteht. Es sollten also Bedingungen vorliegen, bei denen Stärke
und Härte/Weichheit miteinander konkurrieren können - dann kann
das Pearson-Prinzip angewendet werden:
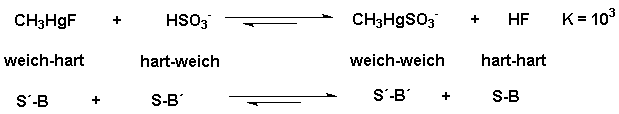
Ein weiteres Bsp.:
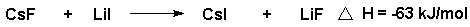
3.
Theorien zum HSAB - Konzept
Obwohl das HSAB-Konzept immer Grunde pragmatisch ist,
scheinen trotzdem theoretische Aspekte nicht uninteressant zu sein. Die
folgenden Theorien können allerdings immer nur Teilaspekte des HSAB-Konzeptes
erklären. Eine umfassende Theorie bzw. Verständnis hat sich bis
heute noch nicht herausgebildet.
3.1. Ionic-covalent
theory, Grimm & Sommerfeld
Es wird in dieser ältesten und wohl offensichtlichsten
Erklärung davon ausgegangen, dass harte Säuren die Basen hauptsächlich
mit ionischen Kräften binden. Begünstigt sind also nach dem HSAB-Konzept
hohe Ladung und kleine Größe. Im Gegensatz dazu wäre bei
dieser Theorie eine weiche Säure mit einer weichen Base eher kovalent
gebunden. Für eine gute kovalente Bindung sollten die beiden gebundenen
Atome möglichst von gleicher Größe und gleicher Elektronegativität
sein. Ionische Bindungen wären für die meisten weichen Säure-Base-Paarezu
schwach, aufgrund der kleinen, bzw. nicht vorhandenen Ladung.
Zusatz: Bei sehr harten Zentren wie MnO4-
ist das Mn(VII) natürlich mit - wenn auch sehr polaren - kovalenten
Bindungen gebunden, so dass die Ladung +7 stark reduziert ist.
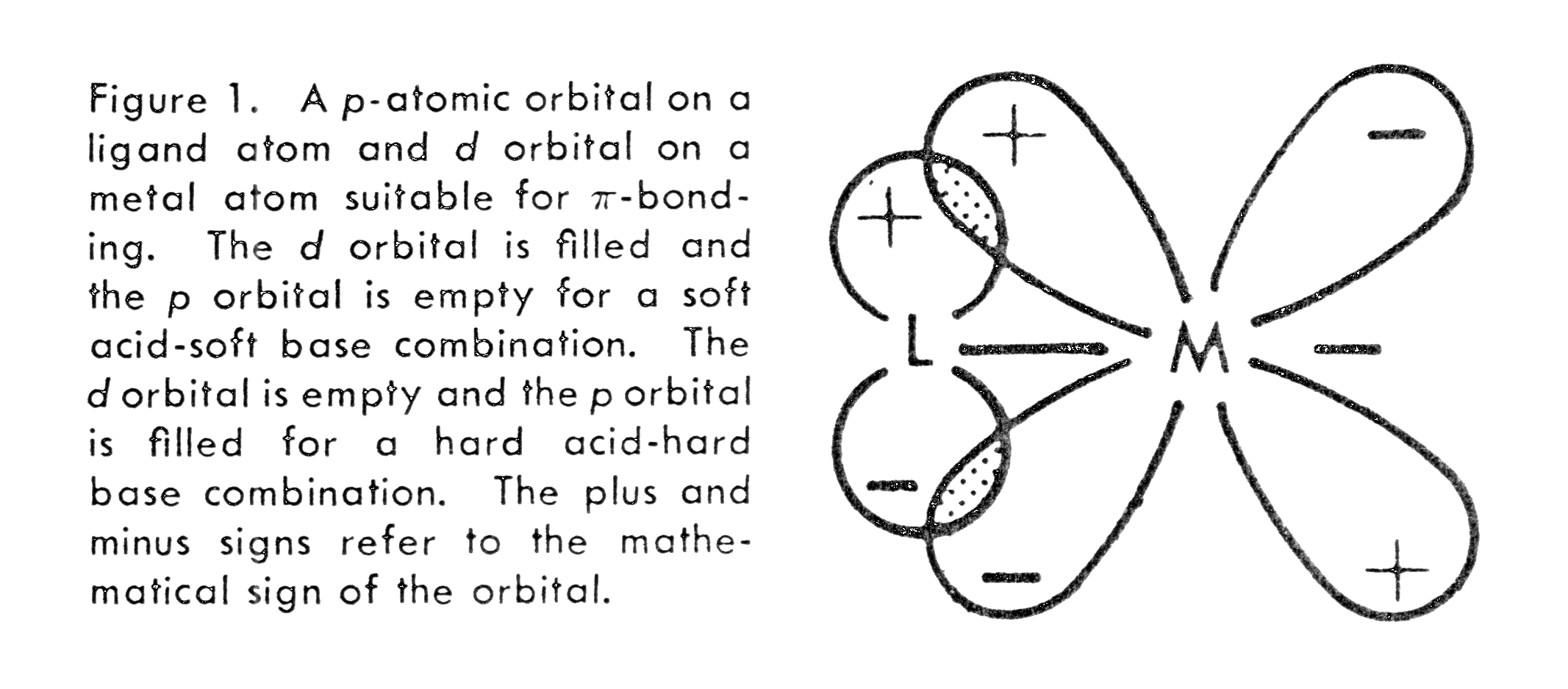
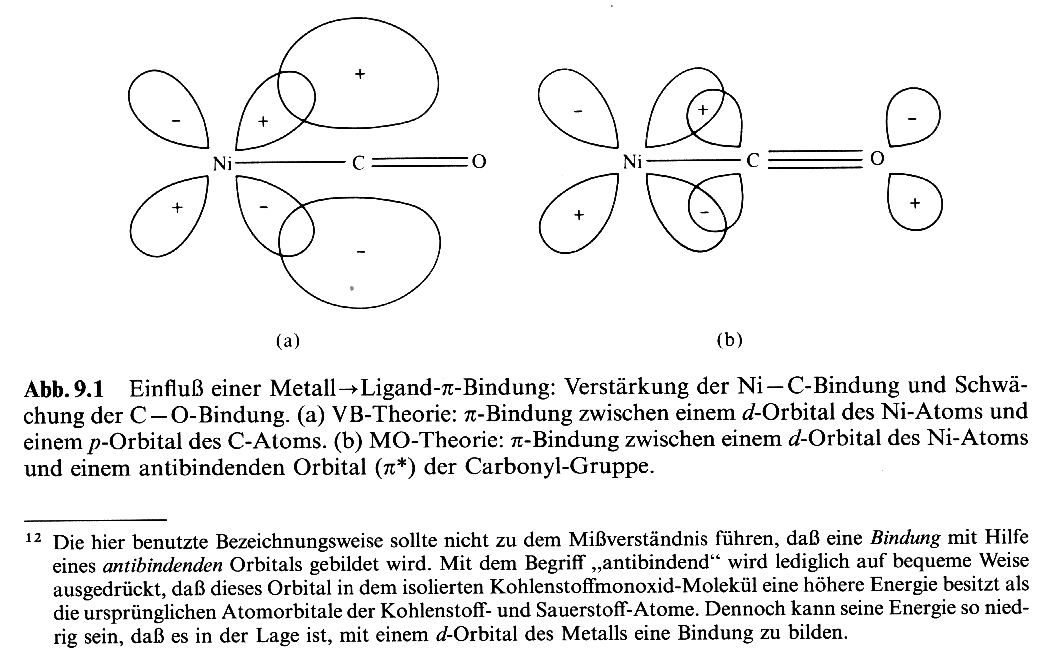
3.2. Pi-bonding
theory, Chatt
Diese Theorie ist v.a. für die Metallionen konstruiert.
Sie zielt darauf ab, dass die wirklich weichen Lewis-Säuren der
Klasse b Übergangsmetallionen mindestens 6 oder mehr d-Elektronen
besitzen. Besonders weiche Lewissäuren wie Hg2+ und Ag+
haben 10 d-Elektronen. Mit dieser polarisierenden Wirkung der d-Elektronen
können die weichen Metallionen pi-Bindungen zu solchen Liganden ausbilden,
die leere d- oder p-Orbitale am Zentralatom der Base besitzen. Solche Liganden
sind P, As, S Br und I, sowie ungesättigte Liganden wie CO und Nitrosylen
(Bei der Bindung zum CO kann nach VB die Überlappung mit dem p-Orbital
angenommen werden, nach MO die Überlappung mit dem pi* - antibindenden
Molekülorbital). Nicht möglich sind solche Wechselwirkungen mit
den Elementen der zweiten Periode wie . Klasse a Säuren besitzen als
harte Säuren weniger als sechs d-Elektronen, d.h. diese Metallionen
haben immer leere d-Orbitale zu Verfügung. Liganden wie das Oxidion
und das Fluoridion können nun in umgekehrter Weise pi-Bindungen zu
den leeren d-Orbitalen der Metallionen ausbilden. Mit weichen Lewissäuren,
die über Elektronen in den d-Schalen verfügen kommt es hierbei
zu Abstoßungskräften zwischen den p-Orbitalen der Liganden und
den d-Schalen der Metallionen.
3.3. van der Waals
dispersion energies, Pitzer
Die sogenannten van der Waals´schen Kräfte
oder London-Kräfte zwischen Atomen oder Gruppen im gleichen Molekül
können zu einer spürbaren Stabilisation des Moleküls führen.
Diese Kräfte hängen vom Produkt der Polarisierbarkeit der wechselwirkenden
Gruppen ab, sowie indirekt proportional von der sechsten Potenz des Abstandes.
Es liegt folglich eine hohe Stabilisierung durch London-Kräfte vor,
wenn beide Gruppen stark polarisierbar sind, d.h. ein Komplex vorliegt,
der aus einer weichen Säure und einer weichen Base besteht. Dies untermauert
die Affinität weicher Säuren und weicher Basen.
3.4. d-p-orbital
hybridization for large atoms, Mullikan
Diese Theorie versucht die besondere Stabilität
von Bindungen zwischen großen Atomen - wie bspw. den beiden Iod-Atomen
- zu erklären. Es wird hierbei angenommen, dass eine Hybridisierung
der p- und d-Orbitale stattfindet, so dass die Pi-bindenden Molekülorbitale
sowie die Pi* - antibindenden Molekülorbitale einen gewissen d-Charakter
besitzen. Dies führt dazu, dass zum Einen eine Stärkung des bindenden
Orbitals durch größere Überlappung, und zum Anderen eine
Schwächung des antibindenden Orbitals durch geringere Überlappung
auftritt, als wenn die Pi-Bindung durch reine p-Orbitale erfolgen würde.
3.5. Quantum mechanical
perturbation theory (Konzept der Grenzorbitale), Klopman
Die Theorie wurde zwar erst für chemische Reaktivitäten
angewandt, lässt sich aber genauso gut auf die Stabilität von
Verbindungen anwenden. Es wird hier v.a. die Wichtigkeit von Ladung und
Grenzkontrollierten Effekten betont. Bei der Bildung des Säure-Base-Adduktes
müssen die Grenzorbitale der Komplexpartner wechselwirken. Dabei ist
das Grenzorbital des Donoratoms, sprich der Base, das höchste besetzte
Molekülorbital (das sog. HOMO) und beim Akzeptoratom - also der Säure
- ist das Grenzorbital das niedrigste unbesetzte Molekülorbital (das
sog. LUMO). Ist nun die HOMO-LUMO-Energielücke zwischen den beiden
Atomen sehr groß, so kann nur ein geringer Elektronentransfer stattfinden,
weshalb der Ionencharakter der Bindung dominierend ist und eine sog. Ladungskontrollierte
Wechselwirkung resultiert. Große Energiedifferenzen der beiden Grenzorbitale
liegt v.a. bei harten Teilchen vor. Bei einer kleinen Energielücke
zwischen HOMO und LUMO tritt ein starker Elektronentransfer vom Donoratom
zum Akzeptoratom auf, der zu hohen kovalenten Anteil in der Bindung der
beiden Atome führt. Diese kleine Energiedifferenz ist charakteristisch
für weiche Teilchen.
Gerade ausgehend von dieser Theorie führten
weitere Bestrebungen, das Verständnis, theoretische Grundlagen und
eine Quantifizierung der Stabilität von Lewis-Säure-Base-Komplexen
zu verbessern. In diesem Zusammenhang wichtige Parameter sind Elektronenaffinität,
Ionisierungsenergie, Polarisierbarkeit, Ladungskapazität und Elektronegativität.
Bspw. ist nach Klopman die absolute Energie des HOMO die Ionisierungsenergie,
die absolute Energie des LUMO Elektronenaffinität, der HOMO-LUMO-Abstand
eines Teilchens zeigt Korrelation mit der Poarisierbarkeit eines Atoms,
usw. Weiterhin wurden gerade in den 80ern neue Versuche unternommen, die
Wechselwirkungen von Säuren und Basen in der Gasphase zu messen, die
wiederum neue und z.T. auch gegensätzliche Erkenntnisse brachten.
Die Wissenschaft ist hier noch sehr im Fluss, es gibt auch gegensätzliche
Theorien (Drago und Pearson). Pearson und Parr haben z.B. 1983 das HSAB-Konzept
erweitert. Die Quantifizierung von Lewissäuren und -basen wird angegeben
durch die sog. chemische Härte. Diese chemische Härte beruht
auf den Parametern Ionisierungsenergie, Elektronegativität und Elektronenaffinität,
und sagt aus, wie leicht oder schwer die Anzahl der Elektronen eines Teilchens
S verändert werden kann.

Literatur:
 |
Huheey, Anorganische Chemie,
Walter de Gruyter,1988. |
 |
Riedel, Anorganische Chemie,
Walter de Gruyter,1994. |
 |
Pearson, R. G.: Hard and
Soft Acids and Bases, Part I + II, JChemEd 45, 1968. |
Auf diesem Webangebot gilt die Datenschutzerklärung der TU Braunschweig mit Ausnahme der Abschnitte VI, VII und VIII.
![]()
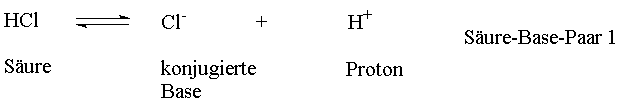
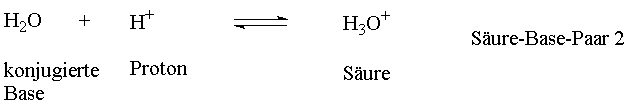
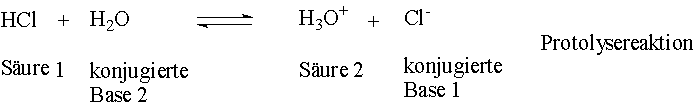
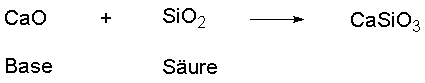
![]()
![]()
![]()
![]()
![]()
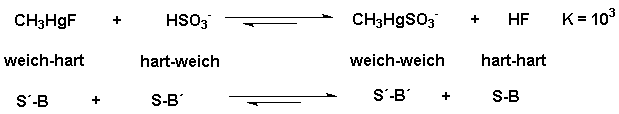
![]()


![]()