Das chemische Potential einer Spezies in einem idealen Gas ist
| µi = µi° + RT ln pi/p° |
Für eine Mischung von (idealem) Gas ist es hilfreich den Molenbruch einzuführen:
µi = µi° + RT ln xi P/p°
Einsetzen in G = Σ niµi ergibt einen Ausdruck für die Gibbsenergie einer idealen Mischung:
G = Σ niµi°
+ RT Σ ni
ln xi + Σ ni
RT ln P/p°
= nt [Σ
xiµi° + RT Σ
xi ln xi + RT ln P/p°]
wobei nt = Σ ni die Gesamtmenge des Gases im System repräsentiert.
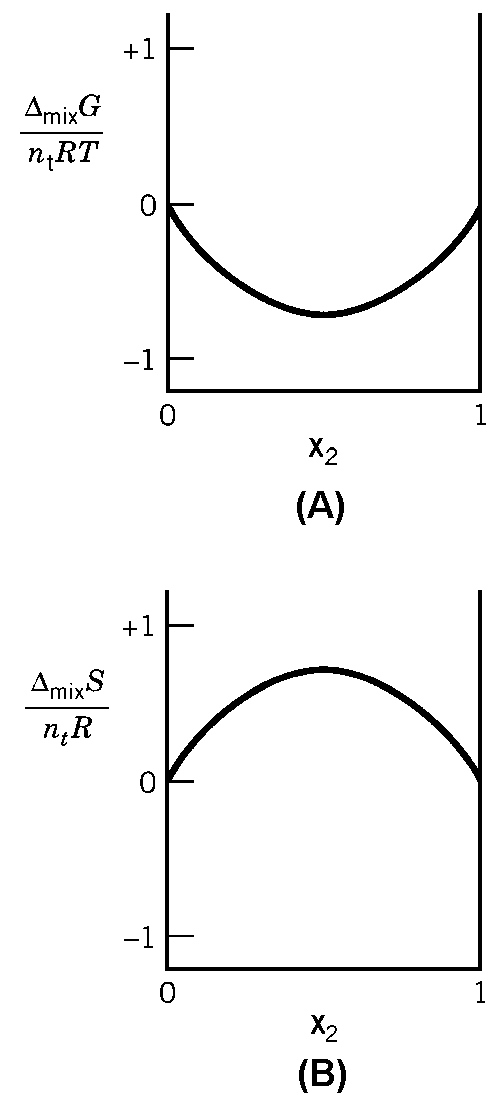 |
| Abb. 1: Änderung der Freien Enthalpie (a) und der Entropie (b) als Funktion des Molenbruchs einer zweikomponentigen Mischung. |
Vor der Mischung sollen sich die Gase in getrennten Kammern bei gleichem
Druck p befinden. Dafür ist G = Σi
ni(µi° + RT ln P/p°).
Für die Änderung der Freien Enthalpie ΔmixG
erhalten wir:
| ΔmixG = Gnachher− Gvorher= ntRT Σi xi ln xi |
Da die Molenbrüche kleiner als eins sind, ist der Logarithmus negativ
und ΔmixG <
0. Dies gibt die Tatsache wieder, dass das Mischen von Gasen ein spontaner
Prozess ist: Wenn zwei Gase zusammengeführt werden, dann diffundieren
sie in einander und die Gasphase wird makroskopisch homogen.
In der Abbildung ist die Änderung der Gibbschen Energie für
die Mischung zweier Gase als Funktion des Molenbruchs einer Spezies dargestellt.
Das Minimum liegt bei x1 = x2 = ½ . Die entsprechende
Abhängigkeit der Entropie ist der unteren Darstellung zu entnehmen.
Es wird (bei idealen Gasen) keine Wärme erzeugt oder verbraucht, da bei idealen Gasen keine Anziehungs- oder Abstoßungskräfte wirken. Energetisch macht es keinen Unterschied, ob die Gase vermischt oder getrennt sind. Die Triebkraft für die Vermischung rührt von der Entropie her. Hier noch der mathematische Beleg für diese Aussage:
Wegen (∂G/∂T)p,n = -S erhalten wir für eine Mischung idealer Gase ΔmixS = -(∂ΔmixG/∂T) = - nRΣixi ln xi .
Das Maximum liegt für 2 Komponenten bei x1 = x2 = 1/2. Die Mischungsenthalpie ΔmixH können wir über ΔG = ΔH - TΔS berechnen: ΔmixH = ΔmixG + TΔmixS = 0, d.h. die Energie ändert sich nicht. Treibende "Kraft" für die Durchmischung ist die Entropie und nicht die Energie.
![]()
Auf diesem Webangebot gilt die Datenschutzerklärung der TU Braunschweig mit Ausnahme der Abschnitte VI, VII und VIII.