Das für theoretische Diskussionen am meisten verwendete und auch bequemste Maß ist der Molenbruch x. Für eine Lösung mit der Einzelkomponente i ist der Molenbruch xi die Stoffmenge dieser Einzelkomponente bezogen auf die Gesamtstoffmenge aller in der Lösung vorhandenen Komponenten.
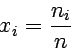
Für ein System aus nur zwei Komponenten gilt 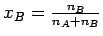
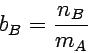
Da man eine Lösung bestimmter Molalität leicht durch genaues
Einwägen herstellen kann, hat auch dieses Konzentrationsmaß
seine Vorzüge. Zwischen der Molalität bB und dem Molenbruch
xB einer Komponente B in einem binären System, in dem die
Komponente A (das Lösemittel) die Molmasse MA besitzt, besteht folgende Beziehung:
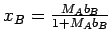
Wenn in verdünnten Lösungen das Produkt mBMA << 1 ist, dann wird der Molenbruch proportional der Molalität: xB≈ bB·MA.
Unter der Stoffmengenkonzentration cB oder Molarität einer Komponente B in einer Lösung versteht man die in einem Einheitsvolumen der fertigen Lösung enthaltene Stoffmenge der betrachteten Komponente ([c] = mol/l).
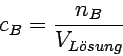
Für bestimmte Zwecke wird als Konzentrationsmaß auch einfach die
Zahl der Teilchen (Atome, Ionen oder Moleküle) pro Volumeneinheit
gewählt: Ci = Ni/V. Für
eine Lösung aus zwei Komponenten, in der MA und MB
die Molmassen von Lösemittel und gelöstem Stoff und ρ für die Dichte der Lösung steht, erhält man den Molenbruch xB durch folgender Umrechnung aus der Stoffmengenkonzentration cB:
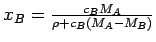
In stark verdünnten Lösungen ist ρ ≈ ρA, der Dichte des reinen Lösemittels, und es ist cB(MA - MB) << ρA und daher gilt:
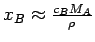
In einem solchen Fall ist also der Molenbruch nahezu proportional der
Molarität.
Für verdünnte wäßrige Lösungen gilt ρ ≈ ρA≈1 kg/l, so dass die Molarität nahezu gleich der Molalität wird. Da sich die Dichte einer Lösung mit der Temperatur ändert, muss sich auch die Molarität cB mit der Temperatur ändern. Die Molalität bB und der Molenbruch xB sind hingegen temperaturunabhängig !
![]()
Auf diesem Webangebot gilt die Datenschutzerklärung der TU Braunschweig mit Ausnahme der Abschnitte VI, VII und VIII.