Bei hinreichend starker positiver Abweichung vom Raoultschen Gesetz bilden die Komponenten eines binären Systems keine lückenlose Mischungsreihe mehr. Gibt man nacheinander kleine Menge der einen Komponenten zu einer vorgegebenen Menge der anderen, dann gelangt man allmählich an eine Löslichkeitsgrenze, bei deren Überschreitung sich zwei ausgeprägte flüssige Phasen bilden. Höhere Temperaturen fördern in der Regel (jedoch nicht immer) die gegenseitige Löslichkeit, da die höhere kinetische Energie das Widerstreben der Komponenten überwindet, sich gegenseitig zu vermischen.
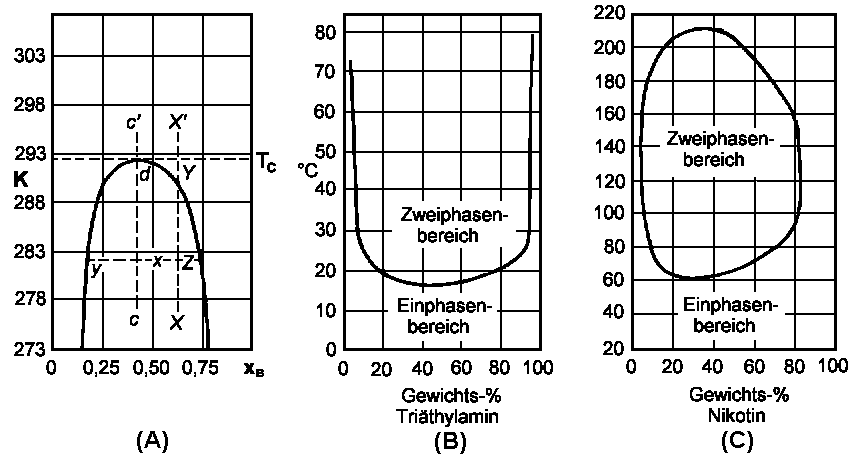
Ein Beispiel für ein solches Verhalten ist das System n-Hexan/Nitrobenzol (T/x-Diagramm der Abbildung). Bei den durch den Punkt x angezeigten Wert für die Temperatur und die Zusammensetzung sind zwei Phasen koexistent (System mit zwei flüssigen Lösungen). Die eine stellt eine verdünnte Lösung von Nitrobenzol in n-Hexan mit der Zusammensetzung y dar, die andere eine verdünnte Lösung von n-Hexan in Nitrobenzol mit der Zusammensetzung z. Die relativen Mengen der beiden Phasen sind durch das Verhältnis der Abstände xy/xz entlang der Verbindungslinie yz gegeben. Wenn man die Temperatur entlang XX' erhöht, dann nimmt die relative Länge der hexanreichen Phase ab, wogegen die relative Menge der nitrobenzolreichen Phase zunimmt. Im Punkt Y verschwindet die hexanreiche Phase völlig: Das Gemisch verwandelt sich in ein Einphasensystem.
 |
| Abb.
1: Partielle Mischbarkeit zweier Flüssigkeiten.
(a) n-Hexan/Nitrobenzol; (b) Triäthylamin/Wasser; (c) Nikotin/Wasser |
Wenn man sich der kritischen Temperatur von höheren Temperaturen aus allmählich nähert, dann kann man ein merkwürdiges Phänomen beobachten. Kurz vor dem Übergang des Systems vom Einphasen- in das Zweiphasengebiet überzieht sich die Lösung mit einer perlmuttartigen Opaleszenz. Diese kritische Opaleszenz wird durch die Streuung des Lichts hervorgerufen. Diese Bereiche bilden sich in der Flüssigkeit kurz vor der Trennung der beiden Phasen. Röntgenuntersuchungen haben gezeigt, dass solche Bereiche auch noch mehrere Grade oberhalb der kritischen Temperatur existent sind.
Merkwürdeigerweise liegt bei manchen Systemen die kritische Lösungstemperatur in einem Minimum. Bei höheren Temperaturen besteht das System aus zwei Phasen; bei allmählicher Abkühlung erreicht man eine Temperatur, bei der die beiden Phasen in jedem Verhltnis mischbar sind. Ein Beispiel hierfür ist das System Triäthylamin/Wasser (siehe Abbildung), das eine untere kritische Lösungstemperatur von 18,5°C bei 1 atm Druck zeigt.
Es wurden auch Systeme gefunden, die sowohl eine obere als auch eine untere kritische Lösungstemperatur besitzen. Solche Systeme findet man vor allem bei höheren Drücken, so dass die Annahme recht plausibel ist, dass alle Systeme mit einer unteren kritischen Lösungstemperatur bei hinreichend hohen Temperaturen und Drücken auch eine obere kritische Lösungstemperatur zeigen. Das System Nikotin/Wasser (siehe Abbildung) zeigt schon bei Atmosphärendruck zwei kritische Temperaturen.
![]()
Auf diesem Webangebot gilt die Datenschutzerklärung der TU Braunschweig mit Ausnahme der Abschnitte VI, VII und VIII.