Das Raoultsche Gesetz
Wir untersuchen das chemische Potential einer Flüssigkeit in Abhängigkeit
von ihrer Zusammensetzumg. Wenn sich ein System im Gleichgewicht befindet,
dann muss das chemische Potential einer als Dampf vorhandenen Substanz
gleich ihrem chemischen Potential in der Flüssigkeit sein µ(l)
= µ(g). Daher verwenden wir die Formel für das chemische Potential
eines perfekten Gases: µ = µ° + RT ln(p/p°).
 |
 |
 |
| Abb.
1:
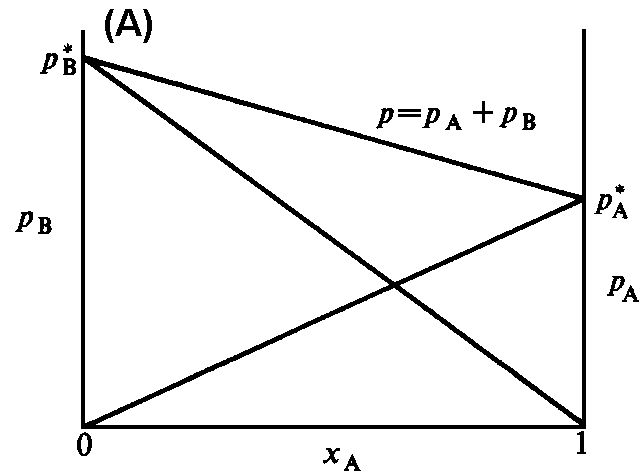
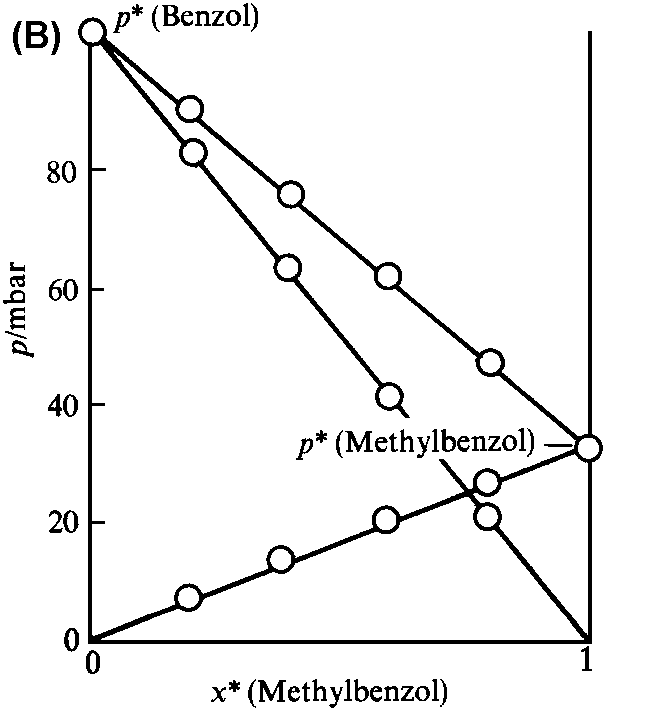
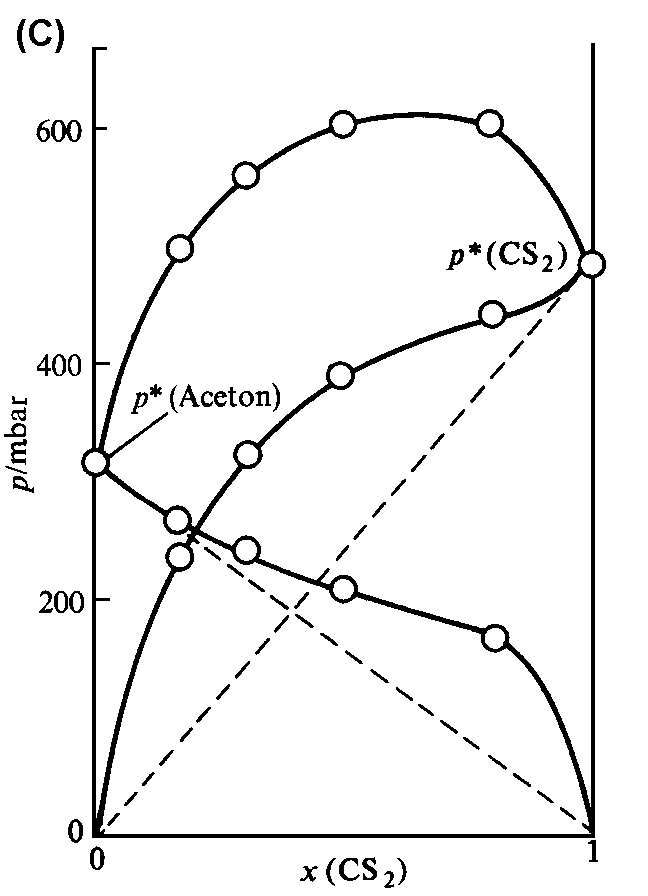
(a) Der Gesamt-Dampfdruck und die beiden Partial-Dampfdrücke sind in einer idealen binären Mischung den Molenbrüchen der Komponenten proportional. (b) Zwei chemisch ähnliche Flüssigkeiten (z.B. Benzol und Methylbenzol) bilden eine nahezu ideale Mischung. (c) Eine Mischung aus chemisch unterschiedlichen Flüssigkeiten (hier Schwefelkohlenstoff CS2 und Aceton) zeigt starke Abweichungen vom idealen Verhalten. |
µA*(l) = µA° + RT ln(pA*/p°).
Wenn mehrere Komponenten vorhanden sind, dann hat die Substanz A jetzt den Dampfdruck pA, und daher ist µA(g) = µA° + RT ln(pA/p°); damit gilt
µA(l) = µA(g) = µA° + RT ln(pA/p°).
Aus den beiden Gleichungen kann man das Standardpotential des Gases
eliminieren, und wir erhalten
| µA(l) = µA*(l) + RT ln(pA/pA*). |
Schließlich wollen wir wissen, wie der Dampfdruck von der Zusammensetzung
der Flüssigkeit abhängt. Der französische Chemiker Francois
Raoult fand bei der Untersuchung von Mischungen aus ähnlichen Flüssigkeiten
(z.B. aus Benzol und Toluol), dass der Quotient pA/pA*
proportional dem Molenbruch von A in der Flüssigkeit ist:
| Raoultsches Gesetz: pA = xApA*. |
Das Raoultsche Gesetz ist in der Abbildung 1a illustriert.
Manche Mischungen erfüllen das Raoultsche Gesetz sehr gut, vor
allem dann, wenn sie aus chemisch ähnlichen Komponenten bestehen (vgl.
Abb. 1b). Man nennt solche Mischungen, die das Raoultsche Gesetz im ganzen
Bereich von reinem A zum reinem B befolgen, ideale Lösungen.
Für diese gilt:
| µA(l) = µA*(l) + RT ln xA. |
Man kann auch diese Gleichung als die Definitionsgleichung einer idealen Lösung ansehen. Die Gleichung gibt das chemische Potential einer idealen Lösung in Abhängigkeit von ihrer Zusammensetzung an.
Während manche Mischungen das Raoultsche Gesetz sehr gut erfüllen, zeigen andere deutliche Abweichungen (Abb. 1c). Aber auch bei Systemen mit starken Abweichungen wird es von der im Überschuß vorhandenen Komponente (dem Lösungsmittel) befolgt, und zwar um so besser, je mehr man sich dem Zustand des reinen Lösungsmittels nähert (Abb. 1c). Daher stellt das Raoultsche Gesetz für das Lösungsmittel eine gute Näherung dar, solange man es mit einer verdünnten Lösung zu tun hat.
![]()
Auf diesem Webangebot gilt die Datenschutzerklärung der TU Braunschweig mit Ausnahme der Abschnitte VI, VII und VIII.