Anwendungen der Standardpotenziale
![]()
Durch Messung der Gleichgewichtszellspannung erhält man auf einfache Weise Gleichgewichtskonstanten, Freie Enthalpien und Entropien verschiedenster Reaktionen (s. Thermodynamische Funktionen). In der Praxis ist es üblich, die Standardwerte dieser Größen zu bestimmen.
Wie wir bereits wissen, verläuft für zwei Redoxpaare Ox1/Red1 und Ox2/Red2 und eine Zelle
Red1, Ox1 || Red2, Ox2 E0 = E20 - E10
die Zellreaktion
Red1 + Ox2 → Ox1 + Red2
in der angegebenen Richtung freiwillig, wenn E0 > 0 und daher E20 > E10 ist. In der Zelle wird Ox2 durch Red1 reduziert; unsere Schlussfolgerung lautet dann
|
Red1 ist (thermodynamisch) bestrebt, Ox2 zu reduzieren, wenn E10 > E20 ist |
Als kurze Faustregel ausgedrückt: Niedrig reduziert hoch. Sehr wichtige Konsequenzen dieser Regel zeigen sich beispielsweise in den Elektronentransferreaktionen der Atmungskette.
Anwendung der elektrochemischen Spannungsreihe
Weil E0 (Zn2+, Zn) = -0,76 V kleiner ist als E0 (Cu2+, Cu) = +0,34 V, ist metallisches Zink (thermodynamisch gesehen), in der Lage, Cu2+-Ionen in wässriger Lösung zu reduzieren.
 Energieumwandlung in lebenden Zellen
Energieumwandlung in lebenden Zellen
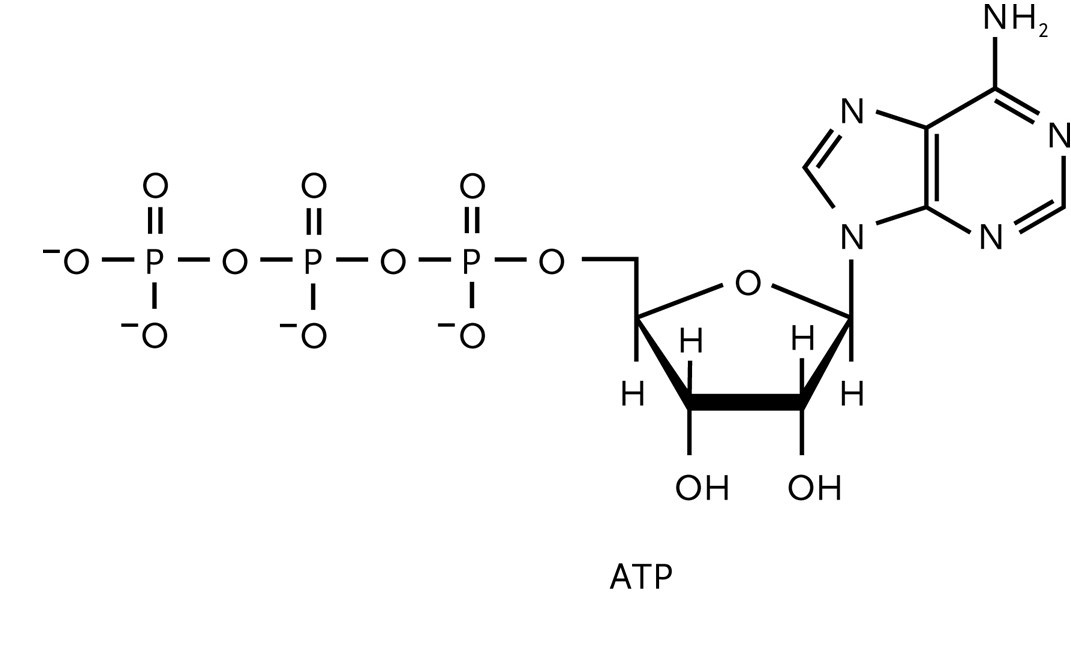
Alle Lebensäußerungen auf der Welt hängen von der Kopplung exergoner und endergoner Reaktionen ab: Die Oxidation von Nährstoffen liefert die Triebkraft für andere Reaktionen. Biologische Zellen speichern die bei der Oxidation der Nahrung frei werdende Energie in Adenosin-Triphosphat (ATP, (Abb.1)). Die Wirkungsweise von ATP beruht auf seiner Fähigkeit, seine endständige Phosphatgruppe hydrolytisch abzuspalten, wobei Adenosin-Diphosphat (ADP) entsteht:
ATP (aq) + H2O (l) ADP (aq) + Pan- (aq) + H3O+ (aq)
(Pan-) bezeichnet einen anorganischen Phosphatrest, zum Beispiel H2PO4-).
Die biologischen Standardwerte für die ATP-Hydrolyse bei Körpertemperatur (37°C bzw. 310 K) sind ΔRGÅ = -31 kJ mol-1, ΔRHÅ = 20 kJ mol-1 und ΔRSÅ = +34 J K-1 mol-1. Unter diesen ist die Hydrolyse folglich exergon (ΔRGÅ < 0) und es steht eine Energie von 31 kJ mol-1 zum Antrieb anderer Reaktionen zur Verfügung.
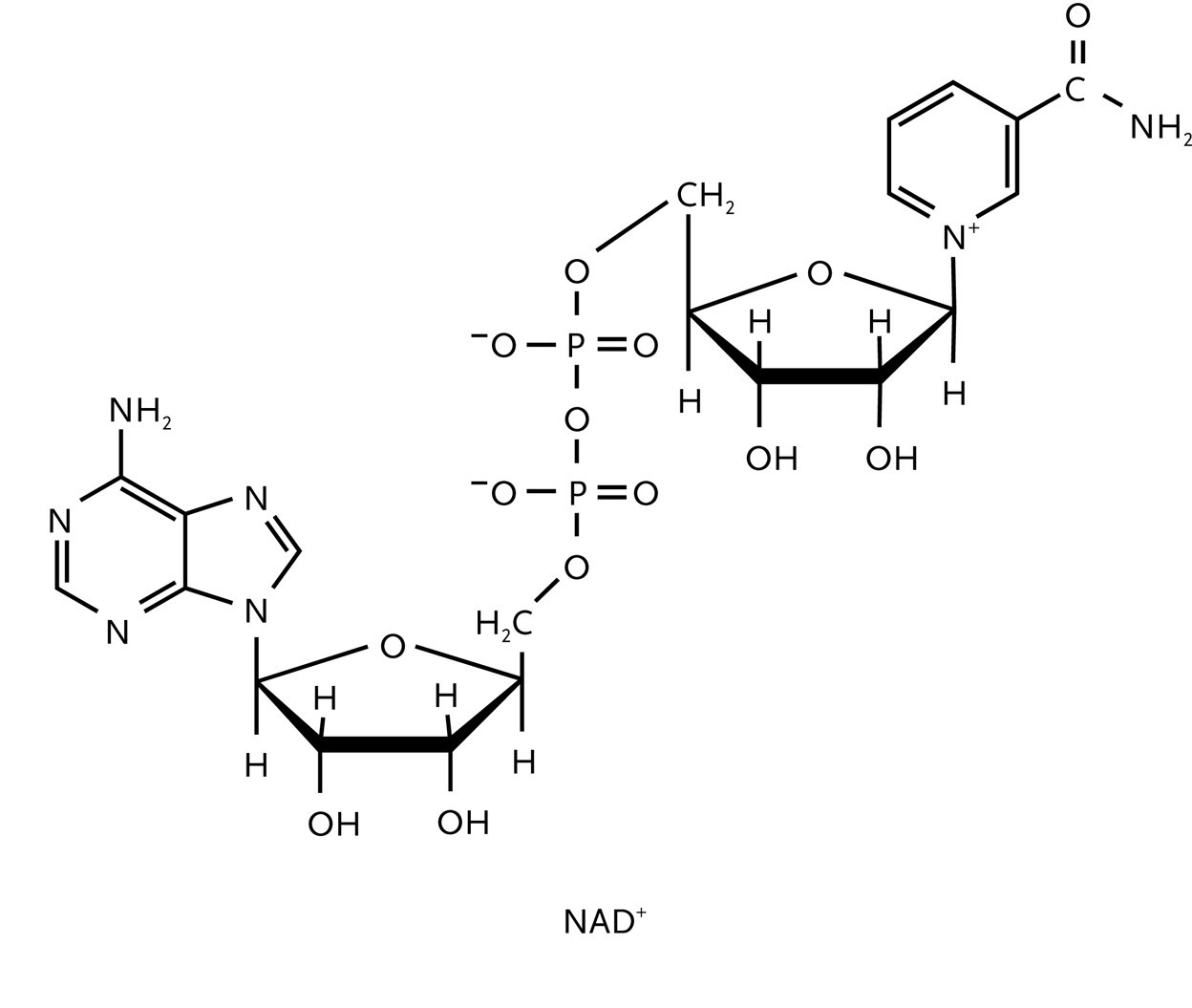
Um zu demonstrieren, wie die Zerlegung der Nährstoffe im Stoffwechsel mit der Bildung von ATP in den Zellen gekoppelt ist, betrachten wir die Oxidation von Glucose mit O2 und H2O. Der erste Schritt ist die Glykolyse, die partielle Oxidation von Glucose durch das Nicotinamid-Adenin-Dinukleotid (NAD+ (Abb. 2)) zum Pyruvat-Ion CH3COCO2-. Dann folgt der Citronensäuresyklus mit der Oxidation von Pyruvat zu CO2. Der letzte Schritt besteht in der Reduktion von O2 zu H2O durch oxidative Phosphorylierung. Die Glycolyse ist die wichtigste Energiequelle im anaeroben Metabolismus, einer Stoffwechselform, die ohne eingeatmeten Sauerstoff auskommt. Der Citronensäurezyklus und die oxidative Phosphorylierung sind die wichtigsten Prozesse der Energiegewinnung aus Kohlenhydraten im aeroben Metabolismus, einer Stoffwechselform, die auf eingeatmeten Sauerstoff angewiesen ist.
Die Glycolyse
Die Glycolyse, eine Abfolge enzymkatalysierter Reaktionen, findet im Cytosol statt, dem von der Zellmembran umschlossenen wässrigen Medium. für die Oxidation von Glucose zu Pyruvat durch NAD+ ist bei Körpertemperatur ΔRGÅ = -147 kJ mol-1. Bei der Oxidation jedes Glucosemoleküls werden zwei Moleküle ADP in ATP umgewandelt. Die Nettoreaktion lautet:
C6H12O6 (aq) + 2 NAD+ (aq) + 2 ADP (aq) + 2 Pan- (aq) + 2 H2O (aq) →
2 CH3COCO2- (aq) + 2 NADH (aq) + 2 ATP (aq) + 2 H3O+ (aq)
Die Freie Standardreaktionsenthalpie ist
[(-147) - 2 · (-31)] kJ mol-1 = -85 kJ mol-1.
Die Reaktion ist exergon und läuft freiwillig ab: Durch die Oxidation von
Glucose wird das ATP wieder "aufgeladen". Herrscht in der Zelle
Sauerstoffmangel, so wird das Pyruvat-Ion von NADH+ zum Lactat-Ion
CH3C(OH)CO2- reduziert. In Hefen sind Ethanol
und CO2 die Endprodukte. Prost! Bei intensiver körperlicher
Betätigung etwa beim Laufen, kann die Sauerstoffkonzentration in den
Muskelzellen stark abfallen. Die erhöhte Konzentration an Lactat-Ionen macht
sich dann als Muskelermüdung (Übersäuerung) bemerkbar. Ein weiteres Feld für die
Sportmedizin, aber auch für Doping-Freunde.
 Der Citronensäurezyklus
Der Citronensäurezyklus
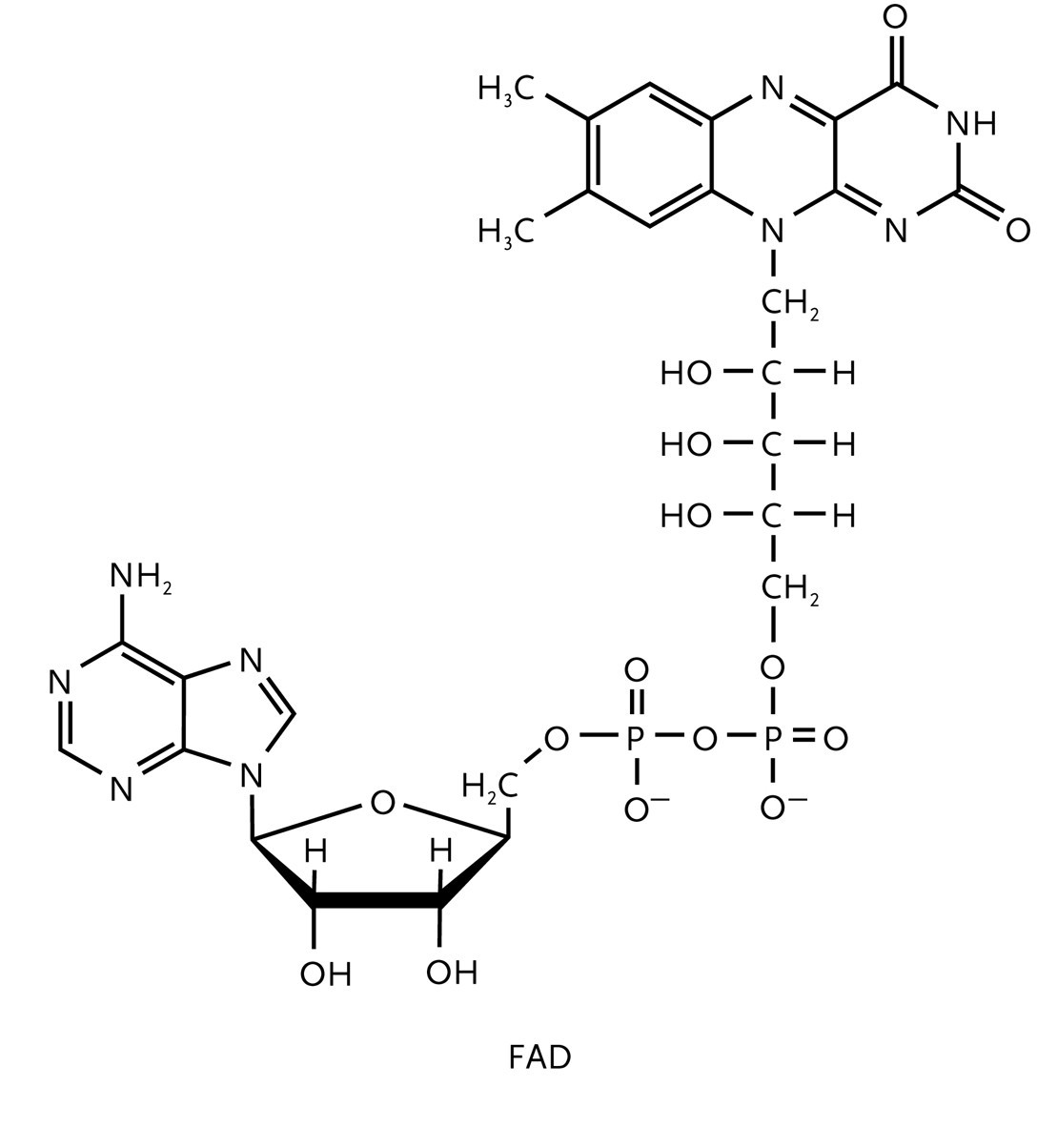
Die Freie Standardverbrennungsenthalpie von Glucose beträgt -2880 kJ mol-1. Die Oxidation im Stadium des Pyruvat-Ions zu beenden, würde deshalb eine schlechte Ausnutzung der Ressourcen bedeuten. In Anwesenheit von O2 wird Pyruvat im Citronensäurezyklus und durch die oxidative Phosphorylierung weiter oxidiert, die in einem speziellen Zellorgan ablaufen, dem Mitochondrium. Acht Enzyme koppeln im Citronensäurezyklus die Synthese von ATP an die Oxidation von Pyruvat durch NAD+ und Flavin-Adenin-Dinukleotid (FAD, (Abb. 3)):
2 CH3COCO2- (aq) + 8 NAD+ (aq) + 2 FAD (aq) + 2 ADP (aq) + 2 Pan- (aq) + 8 H2O (l) →
6 CO2 (g) + 8 NADH (aq) + 2 ATP (aq) + 4 H3O+ (aq) + 2 FADH2 (aq)
NADH und FADH2 reduzieren anschließend O2 durch oxidative Phosphorylierung wobei wiederum ATP entsteht. Pro verbrauchtem Glucosemolekül erzeugen der Citronensäurezyklus und die oxidative Phosphorylierung insgesamt 38 Moleküle ATP; jedes MOL ATP speichert 31 kJ der insgesamt 2880 kJ, die von einem Mol (180 g) Glucose geliefert werden. Insgesamt sind das 1178 kJ, die zum späteren Verbrauch zur Verfügung stehen. Die aerobe Oxidation von Glucose ist folglich wesentlich effekttiver als die Glycolyse.
 Die Atmungskette
Die Atmungskette
Bei der exergonen Oxidation eines Glucosemoleküls werden insgesamt 24 Elektronen auf sechs Sauerstoffmoleküle übertragen. Die Halbreaktionen für die Oxidation von C6H12O6 und die Reduktion von O2 lauten:
C6H12O6 (s) + H2O (l) → 6 CO2 (g) + 24 H+ (aq) + 24 e-
6 O2 (g) + 24H+ (aq) + 24 e- → 12 H2O (l)
Dabei gehen die Elektronen nicht unmittelbar vom Glucosemolekül auf das Sauerstoffmolekül über: Wie wir bereits wissen, wird Glucose in biologischen Zellen durch NAD+ und FAD (Glycolyse, Citronensäurezyklus) zu CO2 oxidiert. Der Gesamtprozess ist
C6H12O6 (aq) + 10 NAD+ + 2 FAD + 4 ADP + 4 Pan- + 2 H2O
6 CO2 + 10 NADH + 2 FADH2 + 4 ATP + 6 H+
In der Atmungskette werden Elektronen, die aus kräftigen Reduktionsmitteln wie NADH und FADH2 stammen, durch vier membrangebundene Proteinkomplexe und zwei bewegliche Elektronenüberträger transportiert, bevor damit O2 zu H2O reduziert wird. Wie wir gleich sehen werden, liefern die Elektronentransferreaktionen die Triebkraft für die ATP-Synthese der Membranproteinkomplexe.
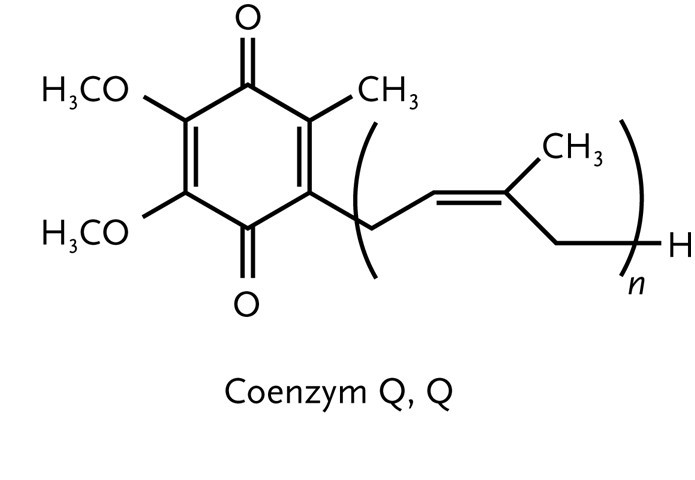
 Die Atmungskette beginnt beim Komplex I (NADH-Q-Oxireduktase)
mit der Oxidation von NADH durch das Coenzym Q (4) in einer
Zwei-Elektronen-Reduktion:
Die Atmungskette beginnt beim Komplex I (NADH-Q-Oxireduktase)
mit der Oxidation von NADH durch das Coenzym Q (4) in einer
Zwei-Elektronen-Reduktion:
|
Komplex I |
||
|
H+ + NADH + Q |
→ |
NAD+ + QH2 |
|
EÅ = +0,42 V, ΔRGÅ = -81 kJ mol-1 |
||
Durch den Komplex II (Succinat-Q-Reduktase) werden weitere Moleküle Q von FADH2 reduziert:
|
Komplex II |
||
|
FADH2 + Q |
→ |
FAD + QH2 |
|
EÅ = +0,015 V, ΔRGÅ = -2,9 kJ mol-1 |
||
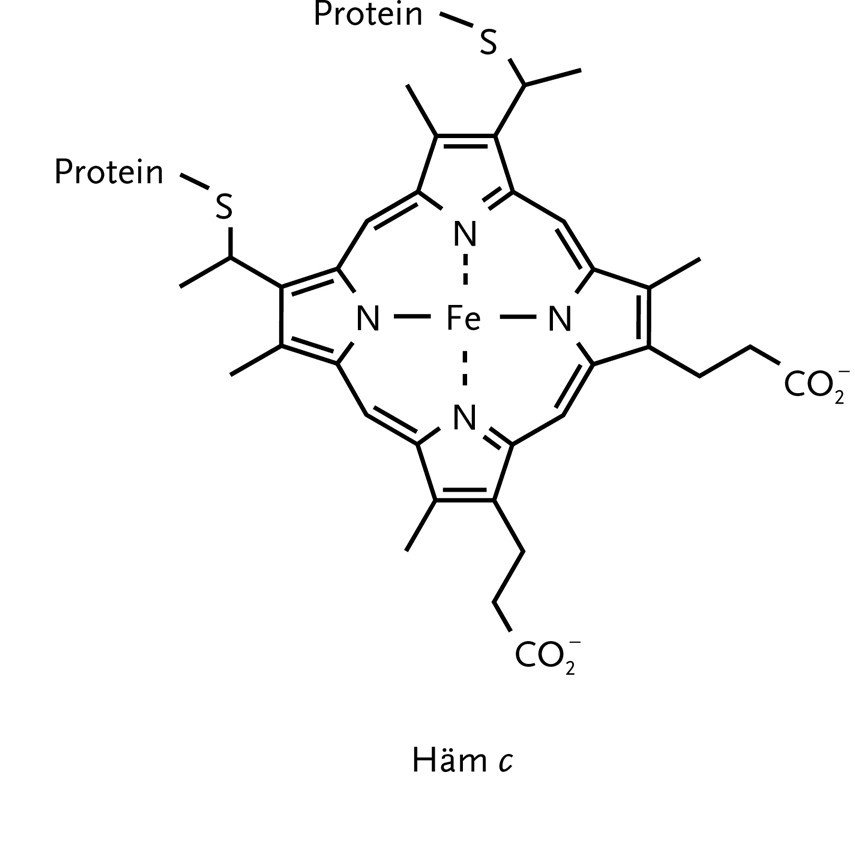
Reduziertes Q wandert dann zum Komplex III (Q-Cytochrom-c-Oxidoreduktase), der die Reduktion des Protein Cytrochrom c (abgekürzt Cyt c) katalysiert. Cytochrom c enthält die Häm-Gruppe (5), dessen zentrales Eisen-Ion in den Oxidationsstufen +3 und +2 vorliegen kann. Die Nettoreaktion der Katalyse lautet
|
Komplex III |
||
|
QH2 + 2 Fe3+ (Cyt c) |
→ |
Q + 2 Fe2+ (Cyt c) + 2 H+ |
|
EÅ = +0,15 V, ΔRGÅ = -309 kJ mol-1 |
||
Das reduzierte Cytochrom c überträgt Elektronen von Komplex III zu Komplex IV (Cytochrom-c-Oxidase). Dort wird schließlich O2 zu H2O rediziert:
|
Komplex IV |
||
|
2 Fe2+ (Cyt c) + 2 H+ + 1/2 O2 |
→ |
2 Fe3+ (Cyt c) + H2O |
|
EÅ = +0,815 V, ΔRGÅ = -109 kJ mol-1 |
||
Oxidative Phosphorylierung
Die oben erläuterten Reaktionen unter Beteiligung der Komplexe I, III und IV liefern genügend Energie, um die Synthese von ATP durch oxidative Phosphorylierung zu ermöglichen:
ADP + Pan- + H+ → ATP
ΔRGÅ = 31 kJ mol-1
Wie wir gesehen haben, kann die Phosphorylierung von ADP zu ATP an die exergone Dephosphorylierung anderer Moleküle gekoppelt werden. Nach diesem Mechanismus wir während der Glycolyse und des Citronensäurezyklus ATP synthetisiert. Die oxidative Phosphorylierung verläuft allerdings nach einem anderem Mechanismus.
ABB zeigt die Struktur eines Mitochondriums. Die Proteinkomplexe, die eine Rolle für die Elektronentransportkette spielen, befinden sich an der inneren Membran, während die Phosphorylierung selbst im Intermembran-Raum stattfindet. Die Freie Enthalpie der Reaktionen der Komplexe I, III und IV wird zunächst verwendet, um Protonen durch die membran des Mitochondriums zu bewegen. Durch die symmetrische Anordnung der Komplexe in der Membran können die Protonen, die auf einer Seite der Membran abgespalten werden, auf der anderen Seite angelagert werden. So werden während der Oxidation von NADH durch Q im Komplex I vier Protonen durch die Membran transportiert; daneben trägt auch die Kopplung von Elektronentransfer und Protonenpumpen in den Komplexen III und IV dazu bei, dass sich ein Protonengradient über der inneren Membran ausbildet. Unter Verwendung der in diesem Gradienten gespeicherten Energie phosphoryliert das Enzym H+-ATPase ADP zu ATP. Experimentell hat man gefunden, dass aus drei Molekülen NADH und einem Molekül FADH2, die in der Atmungskette oxidiert werden, insgesamt jeweils elf Moleküle ATP entstehen. Je nach Bedarf wird das ATP in der Zelle hydrolysiert, um Energie für andere biochemische Reaktionen zu gewinnen.
Wie die H+-ATPase ATP aus ADP synthetisiert, erklärt die chemiosmotische Theorie von Peter Mitchell (Nobelpreis für Chemie 1978). Die Energie, die von einem Protonengradienten über eine Membran gespeichert wird, setzt sich aus zwei Beiträgen zusammen. Erstens führt die Differenz der Aktivität von H+-Ionen zu einer Differenz der molaren Freien Energie auf beiden Seiten der Membran:
ΔGm,1 = Gm,innen - Gm,außen = R T ln (aH+,innen/aH+ außen)
Zweitens entsteht eine Potenzialdifferenz ΔΦ = Φinnen - Φaußen über die Membran durch Unterschiede in den Coulomb-Wechselwirkungen auf beiden Seiten. Die Ladungsdifferenz pro Mol Wasserstoff-Ionen ist gleich NAe = F. Die Differenz der molaren Freien Enthalpie ist durch
ΔGm,2 = FΔΦ
gegeben. Die Summe beider Beiträge ist die Freie Enthalpie, gespeichert durch einen Aktivitätsgradienten und einen Potenzialgradienten:
ΔGm = - RT ln ([H+]innen/[H+]außen) + FΔΦ
(hier wurden die Aktivitäten durch Konzentrationen ersetzt). Mithilfe dieser Gleichung kann man auch abschätzen, wie viel Energie für die Phosphorylierung von ADP verfügbar ist. Wir verwenden ln[H+] ≈ ln 10 lg[H+] und setzen ein ΔpH = pHinnen - pHaußen = - lg[H+]innen + lg[H+]außen. Es ergibt sich
ΔGm = FΔΦ - (RT ln10) ΔpH
Im Fall eines Mitochondrium ist ΔpH ≈ -1,4 und ΔΦ ≈ 0,14 V, also ist ΔGm = +21,5 kJ mol-1. Weil für die Phosphorylierung 31 kJ mol-1 benötigt werden, müssen also mindestend 2 Mol Wasserstoff-Ionen (vielleicht sogar mehr) durch die Membran transportiert werden, damit ein Mol ADP phosphoryliert werden kann.
![]()
Auf diesem Webangebot gilt die Datenschutzerklärung der TU Braunschweig mit Ausnahme der Abschnitte VI, VII und VIII.