Institut für Physikalische und Theoretische Chemie
TU-Braunschweig
- Übungsblatt zur Vorlesung Physikalische
Chemie I
-
Thermodynamik, Kinetik -
Sommersemester 2006
Prof. Dr. K.-H. Gericke, Dipl. Chem. Jan Frähmcke,
Dipl. Chem. Sebastian Kauczok
1) Adiabatische Prozesse sind häufig gute
Näherungen für Abläufe in der Atmosphäre. Betrachten Sie ein Luftpaket, das in
Bodennähe gelangt und sich dort infolge der Sonneneinstrahlung erwärmt. Dadurch
wird seine Dichte geringer als die der Umgebung und es resultiert ein Auftrieb. Die nun
eintretende Expansion entsprechend dem abnehmenden äußeren Druck sei
adiabatisch reversibel (ideales Gas!). Zusätzlich zum Druckgradienten
existiert noch ein T-Gradient der für
die Troposphäre (bis ca. 11000 m) linear angenommen werde: T = T0 –
a Δh (a = 0,006 K m-1). Die
Barometrische Höhenformel erscheint dann als Gl.1. a) Zeigen Sie, dass für die
Temperatur des aufsteigenden Luftpakets Gl.2 gilt. b) Ab welcher Höhe würde man
Wolkenbildung erwarten, wenn der Taupunkt bei dem entsprechenden Feuchtigkeitsgehalt
bei 6°C liegt (Text,0 = 288 K, T0 = 298 K, Cv,m = 20,74 J K-1 mol-1,
M = 28 g/mol)?
Gl.1 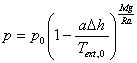 Gl.2
Gl.2 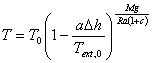
Text,0: T der Umgebungsluft in
Bodennähe; T0: Anfangstemperatur des Luftpakets; a: konstanter Temperaturgradient
2) Die Wärmekapazität wird häufig in der folgenden
Form angegeben (Index m à molar): Cp,m
= a + bT + c/T2. Berechnen Sie die
Änderung der molaren Enthalpie von CO2, wenn das Gas von 15°C auf
37°C erwärmt wird (a = 44,22 J K-1 mol-1, b = 8,79 10-3
J K-2 mol-1, c = -8,62 105 J K mol-1).
3) Geben Sie Beziehungen für die isotherme
Kompressibilität κ = -1/V (∂V/∂p)T und den isobaren
Ausdehnungskoeffizienten α = 1/V (∂V/∂T)p (Sie
brauchen die implizite Differentiation!) eines van-der-Waals-Gases an. Zeigen
Sie mithilfe dieser Beziehung, dass κ und α über die Beziehung κ
R = α (Vm-b) (Vm
: Molvolumen) zusammenhängen. Verifizieren Sie das
Ergebnis weiterhin mithilfe der Eulerschen Kettenregel (∂x/∂y)z
(∂y/∂z)x (∂z/∂x)y = -1 und der
Inversionsregel (∂x/∂y)z = 1/(∂y/∂x)z.
Berechnen Sie zusätzlich κ und α für ein ideales Gas.
4) Bei einer Fahrradpumpe nehme man an, die Luft
werde zunächst adiabatisch auf ein fünftel ihres ursprünglichen Volumens
komprimiert. Betrachten Sie die Luft hierbei als ideales Gas. Um welchen Faktor
ändert sich die Temperatur der Luft, wenn man die Wärmekapazität von N2
mit Cv,m = 20,74 J K-1 mol-1
für Luft zugrunde legt? Weshalb verbrennen Sie sich trotzdem nicht die Finger?