Mit Hilfe der kinetischen Gastheorie können wir berechnen, wie
häufig Teilchen zusammenstoßen und welchen Weg sie im Mittel
zwischen zwei Stößen zurücklegen.
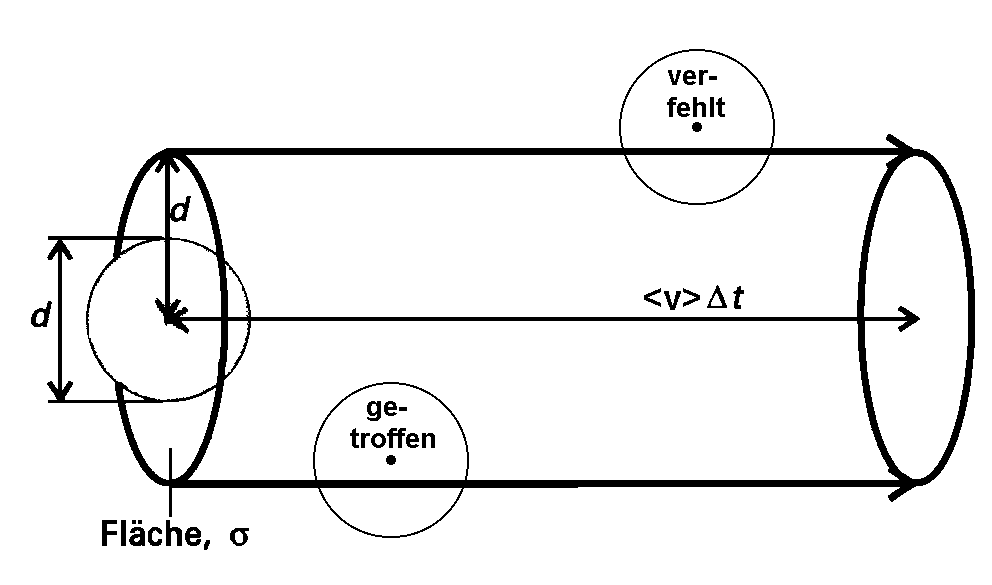 |
| Abb. 1: Der Stoßzylinder für ein Molekül mit dem Durchmesser d während einer Zeit Δt hat die Gestalt eines Kreiszylinders mit dem Radius d und der Länge <v>Δt. Jede Begegnung mit einem Molekül, dessen Mittelpunkt innerhalb des Stoßzylinders liegt, führt zu einem Treffer. In Wirklichkeit ist der Zylinder nicht gerade, sondern ändert bei jedem Stoß seine Richtung. Sein Volumen wird davon jedoch nicht beeinflußt, so dass wir ihn in unseren Rechnungen vereinfacht als gerade auffassen können. |
|
µ = mAmB/(mA + mB) |
|
|
Wir können nun die mittlere freie Weglänge λberechnen.
Wenn ein Teilchen z Stöße pro Zeiteinheit erleidet, dann verbringt
es die Zeit 1/z im freien Fluge zwischen zwei Stößen zurück
und legt dabei die Strecke (1/z)<v>
zurück. Die mittlere freie Weglänge ist daher gegeben durch
|
|
λist also dem Druck umgekehrt proportional.
Die Stoßzahl z gibt an, wie viele Stöße ein Teilchen pro Zeiteinheit erleidet. Multipliziert man z mit ½Ñ, so erhält man die Anzahl aller Stöße pro Zeiteinheit und pro Volumeneinheit zwischen den Teilchen eines Gases. Der Faktor ½ gewährleistet, dass die Stöße A1...A2 und A2...A1 nur einmal gezählt werden. Die Anzahl der Stöße pro Zeiteinheit und pro Volumeneinheit ist
ZAA = ½z (N/V) = 1/2½ σ<v>(N/V)2.
Nach Eingeben der mittleren Geschwindigkeit erhalten wir:
|
|
Die Tabelle gibt einige typische Werte für die Stoßquerschnitte
wieder.
| Stoßquerschnitte | |
| Molekül | σ / nm2 |
| He | 0,21 |
| N2 | 0,43 |
| CO2 | 0,52 |
| C6H6 | 0,88 |
Wenn es sich um Stöße zwischen unterschiedlichen Molekülen
1 und 2 handelt, ist der Stoßquerschnitt ebenfalls durch σ
= πd2 gegeben, aber mit d = ½
(dA + dB). Ein Teilchen der Sorte A erleidet in
der Zeiteinheit mit NB Teilchen der Sorte B zAB = σ<vrel>NB/V
Stöße. Weil es insgesamt NA Teilchen der Sorte A gibt, ist die
Gesamtzahl der Stöße A-B in der Zeiteinheit (σ<vrel>NB/V)NA;
die Gesamtzahl der Stöße A-B in der Zeit- und Volumeneinheit
beträgt:
|
= σ(8kT/πµ)½ . N2Avogadro [A][B] |
mit [A] = nA/V und [B] = nB/V
Stöße von Teilchen an Oberflächen
Es werden alle Teilchen in dem Volumen AvxΔt, die eine positive Geschwindigkeitskomponente vx haben, innerhalb der Zeitspanne Δt an die Wand stoßen. Die mittlere Zahl aller Stöße in diesem Zeitabschnitt ist dann gleich dem Mittelwert dieser Größe multipliziert mit der Teilchendichte (N/V):
Zahl der Stöße = ÑAΔto∫∞vx f(vx)dvx.
o∫∞vx f(vx)dvx = (m/2πkT)½o∫∞vxe-mv²x/2kTdvx = (kT/2πm)½.
Die Anzahl der Stöße mit der Oberfläche pro Zeiteinheit
und pro Flächeneinheit ist dann
|
= 1/4 <v> N/V = 1/4 <v>p/ kT = p/(2πmkT)½. |
![]()
Auf diesem Webangebot gilt die Datenschutzerklärung der TU Braunschweig mit Ausnahme der Abschnitte VI, VII und VIII.