Bei einer Reaktion erster Ordnung ist die zeitliche Konzentrationsänderung proportional zur Konzentration:
- d[A]/dt = k1 [A]
mit k1 als Proportionalitäts- bzw. Geschwindigkeitskonstante. Wenn wir diese Gleichung etwas umformen und zu endlichen Änderungen übergehen (d → Δ),
Δ[A]/[A] = k1 Δt,
dann erkennen wir, dass die relative Stoffmengenänderung Δ[A]/[A] zur vergangenen Zeit Δt proportional ist, d.h. in einer bestimmten Zeit wird von einer Anfangskonzentration immer der gleiche relative Anteil umgesetzt. Liegt beispielsweise anfangs ein Edukt einmolar vor (c0 = 1M), wird es nach einer gewissen Zeitspanne Δt nur noch mit c(t0+Δt) = 0,8 M vorhanden sein. Ist c0 = 3 M, wird innerhalb von Δt die Konzentration ebenfalls um ein Fünftel fallen, man misst dann 2,4 M als Molarität des Eduktes.
Beispiele für Prozesse 1. Ordnung kommen in der Natur sehr häufig vor: Der radioaktive Zerfall von Plutonium erfolgt z. B. nach einem Gesetz erster Ordnung. Wenn man eine konstante Ausgangsmenge (z.B. 1 Tonne) lagert, dann ist nach ca. 30 000 Jahren nur noch die Hälfte dieser Ausgangsmenge (also 500 kg) vorhanden. Nach weiteren 30 000 Jahren wiederum die Hälfte (also 250 kg) und so weiter...
Aber auch die Lautstärke des Quakens einer Ente erfolgt nach dem Gesetz 1. Ordnung. Die Lautstärke des nachfolgenden "Quakers" hat um einen bestimmten Faktor (d.h. Prozentsatz) gegenüber dem unmittelbar vorhergehenden "Quaker" abgenommen.
Wenn wir eine Farbstofflösung mit einem kurzen Lichtblitz anregen, dann erfolgt die Abstrahlung des Lichtes ebenfalls nach einem Gesetz erster Ordnung, d.h. die Zahl der Farbstoffmoleküle die in einer bestimmten Zeit Δt Licht abstrahlen ist proportional zur Zahl der (noch) angeregten Moleküle.
Lösen wir nun die DGL für die Reaktion erster Ordnung: Der beste Weg ist eine so genannte Separation der Variablen, das bedeutet, wir müssen auf jeder der beiden Seiten der Gleichung nur eine Variable haben, also links nur Größen die von [A] und rechts nur Größen die von t abhängen:
d[A]/[A] = −k1dt
Nun können wir diese Gleichung sehr einfach integrieren. Wir gehen als Randbedingung von der plausiblen Annahme aus, dass zur Zeit t = 0 die Anfangskonzentration [A]0 betragen hat:
[A]o∫[A] d[A]/[A] = − k1 0∫t dt = − k1t
Die Lösung des Integrals auf der linken Seite ist recht einfach ( ∫ dx/x = ln x), so dass wir nach Einsetzen der Grenzen sofort erhalten:
ln [A] - ln [A]o = ln [A]/[A]o = − k1t
Tragen wir im Experiment den natürlichen Logarithmus der zu einer
Zeit gemessenen Konzentration [A] für verschiedene Zeiten auf, dann
ergalten wir eine Gerade (falls der Zerfall von A nach 1. Ordnung erfolgt),
deren Steigung die Geschwindigkeitskonstante k1 ist. Wir können
die obige Gleichung durch in die e-te Potenz auflösen:
| [A] = [A]o e−k1 t |
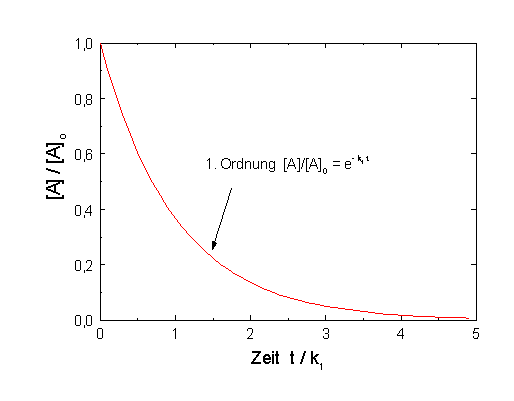 |
| Abb.1: Der zeitlicher Verlauf einer Reaktion 1. Ordnung ist unabhängig von der Anfangskonzentration [A]o. |
| t½ = ln 2/k1 bzw. k1 = ln 2/t½ |
Ein etwas weniger griffiger Begriff als die Halbwertszeit ist die Zeit
τ
innerhalb der die Konzentration auf ein e-tel (1/e) ihres Ausgangswertes
abgefallen ist:
| τ = 1/k1 |
Das Zerfallsgesetz lautet dann:
| [A] = [A]o e- t / τ |
Wenn A in die Produkte B und C zerfällt, A → B + C, wie ist dann der zeitliche Verlauf für die Produkte B, bzw. C? Da d[B]/dt = d[C]/dt = − d[A]/dt = k1[A] ist, muss gelten:
d[B] = k1 [A]o e−k1t dt
Integration unter der Randbedingung, dass zum Zeitpunkt t = 0 kein B vorhanden ist, d.h. [B]o = 0, ergibt:
[B] = k1 [A]o o∫t e−k1 t dt = [A]o (1 − e−k1 t )
Wir haben also [B](t) erst bestimmen können, nachdem [A](t) bekannt war. Durch Einführen einer Umsatzvariablen x brauchen wir nur einmal zu integrieren, um sowohl [A] als auch [B] zu bestimmen. Für eine Reaktion 1. Ordnung A → B + C sei A in einer Ausgangskonzentration [A]0 vorhanden. Nach der Zeit t sollen sich x Anteile der Komponente A umgesetzt haben; die noch vorhandene Konzentration an A beträgt zu dieser Zeit [A]0 − x; zu gleicher Zeit haben sich je x Anteile der Komponenten B und C gebildet. Allgemein ist daher [B] = [B]o + x. Falls am Anfang kein B vorliegt, d.h. [B]o = 0, gilt [B] = x. Die Bildungsgeschwindigkeit von B und C beträgt daher dx/dt; diese Bildungsgeschwindigkeit ist bei einer Reaktion 1. Ordnung proportional zur jeweiligen Konzentration von A:
dx/dt = k1 ([A]o− x)
Durch Separation von x und t erhalten wir:
dx/([A]o − x) = k1 dt
Die übliche Ausgangsbedingung ist, dass zur Zeit t = 0 auch
x = 0 ist. Nach entsprechender Integration der Gleichung und Auflösen
nach x erhält man:
| x = [A]o (1 − e−k1 t ) |
Wir finden also für die zeitliche Konzentrationsänderung der
Produkte B und C:
| [B] = [C] = [A]o (1 − e−k1 t ) |
und für [A] = [A]0 − x:
| [A] = [A]o e−k1 t |
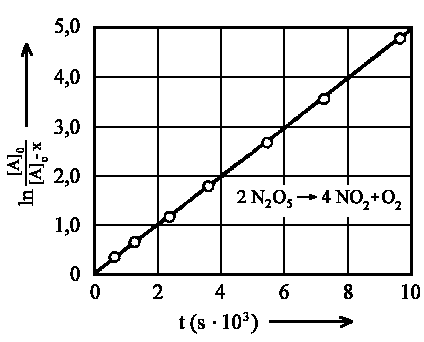 |
| Abb. 2: NO2-Produktbildung beim thermischen Zerfall des Distickstoffpentoxids (Reaktion 1. Ordnung). |
Wenn man die Zahlenwerte
| ln {[A]o/([A]o - x)} = k1t |
gegen t aufträgt, dann erhält man eine Gerade, die durch den Ursprung geht. Die Steigung der Geraden ist gleich dem Zahlenwert der Geschwindigkeitskonstanten k1 für diese Reaktion 1. Ordnung.
![]()
Auf diesem Webangebot gilt die Datenschutzerklärung der TU Braunschweig mit Ausnahme der Abschnitte VI, VII und VIII.