der Reaktionsgeschwindigkeit
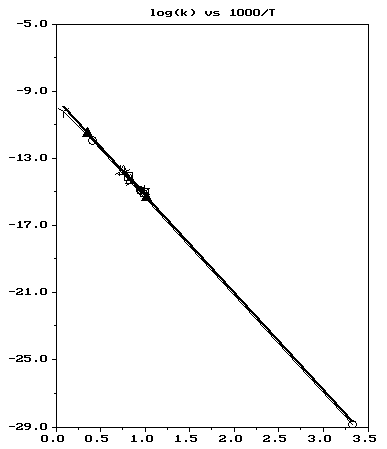 |
| Abb.1: Die Temperaturabhängigkeit der Reaktion H + CO2 → OH + CO. Ergibt die Auftragung von ln k gegen 1/T eine Gerade, dann wird k(T) durch die Arrheniussche Gleichung beschrieben. |
Bei den meisten Reaktionen nimmt die Geschwindigkeit zu, wenn man die
Temperatur erhöht. In umfangreichen Studien fand Arrhenius, dass
für sehr viele Reaktionskonstanten die nach ihm benannte Arrheniussche
Gleichung gilt:
| k = A e−Ea/RT |
Man kann diese Gleichung auch in der Form
ln k = ln A − Ea/RT
schreiben. Danach erhält man eine Gerade, wenn man ln k gegen
1/T
aufträgt. A nennt man den präexponentiellen
Faktor oder auch Frequenzfaktor,
Ea
die Aktivierungsenergie. In der Tabelle sind einige experimentelle
Werte zusammengestellt:
| Arrhenius-Parameter | ||
| (1) Reaktionen
erster Ordnung |
A / s-1 | Ea / kJ mol-1 |
| N2O5 → NO2
+ NO3
CH3NC → CH3CN 2 N2O5 → 4 NO2 + O2 |
1,2 · 1015
3,8 · 1013 6,31 · 1014 |
92,8
161 88 |
| (2) Reaktionen
zweiter Ordnung |
A | Ea / kJ mol-1 |
| O + H2 → OH + H
OH + H2 → H2O + H H + CO2 → OH + CO C2H5ONa + CH3I in Ethanol |
7,1· 10-11 Molek-1s-1
3,5· 10-10 Molek-1s-1 8,0 · 1010 mol-1s-1 2,4 · 1011 mol-1s-1 |
109,6
41,1 42,0 81,6 |
In manchen Fällen gehorcht die Temperaturabhängigkeit nicht
der Formel von Arrhenius; man kann sie aber dennoch beschreiben, wenn man
die Aktivierungsenergie folgendermaßen definiert:
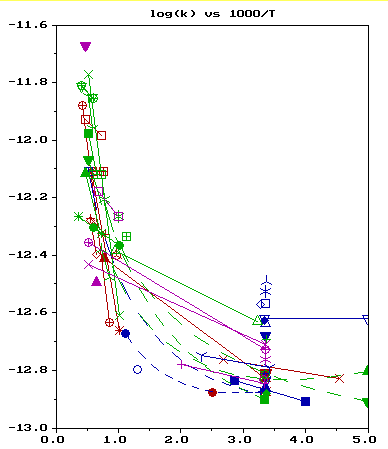 |
| Abb. 2: Die Temperaturabhängigkeit der Reaktion OH + CO → H + CO2 kann nicht durch die Arrheniussche Gleichung beschrieben werden, da eine Auftragung aller gemessenen k(T)- Werte in der Form ln k(T) gegen 1/T keine Gerade ergibt. |
Ea = RT2 (∂ln k/∂T).
Wenn die Aktivierungsenergie nicht von der Temperatur abhängt, kann man diese Gleichung mit Hilfe der Beziehung d (1/T) = − dT/T² umformen:
Ea = − R d ln k/d (1/T).
Diese Gleichung geht beim Integrieren, wenn Ea konstant ist, in die Arrheniussche Gleichung über. Sie gilt aber allgemeiner, denn man kann mir ihrer Hilfe Ea bei einer beliebigen Temperatur aus der Steigung der Kurve von ln k gegen 1/T ermitteln, auch wenn man keine Gerade erhalten hat. Die Temperaturabhängigkeit der Geschwindigkeitskonstante ist umso stärker, je größer die Aktivierungsenergie ist.
Man kann die Arrhenius-Gleichung ganz allgemein aus der Stoßtheorie
der chemischen Reaktionen herleiten, und natürlich auch aus anderen
realitätsnäheren Theorien der Reaktionsgeschwindigkeit. Die Stoßtheorie
der Gasphasen-Reaktionen geht von zwei Annahmen aus: Die Reaktion ist
(a) proportional zur Anzahl der Stöße, die die Reaktionspartner
untereinander erleiden, und
(b) proportional zur Wahrscheinlichkeit, dass
bei einem Stoß genügend Energie vorhanden ist, damit die Reaktion
erfolgen kann.
Sie setzt voraus, dass infolge eines Stoßes nur dann chemische
Bindungen gelöst und neu eingegangen werden, wenn die kinetische Energie,
mit der die Stoßpartner kollidieren, über einem Mindestwert
Ea liegt. Man spricht daher auch von der Aktivierungsenergie.
![]()
Auf diesem Webangebot gilt die Datenschutzerklärung der TU Braunschweig mit Ausnahme der Abschnitte VI, VII und VIII.