der Michaelis-Menten-Mechanismus
Enzyme sind homogene Biokatalysatoren - in der Natur allgegenwärtige, spezialisierte Proteine oder Nukleinsäuren. Ihre Molekülstruktur enthält ein aktives Zentrum, verantwortlich für sie Bindung der Substrate (der Ausgangsstoffe der jeweiligen Reaktion) und die Synthese der Produkte. Wie jeder Katalysator bleiben Enzyme nach Beendigung der Reaktion unverändert zurück. Die meisten Enzyme sind Proteine; manche enthalten an den aktiven Zentren organische oder anorganische Cofaktoren.
Will man die Kinetik einer enzymatischen Reaktion untersuchen, so misst man in der Regel die Anfangsgeschwindigkeit der Produktbildung in einer Lösung, die sehr geringe Konzentrationen des Enzyms enthält.
Die grundlegenden Merkmale einer enzymatischen Reaktion sind:
Diese Merkmale werden durch den Michaelis-Menten-Mechanismus reproduziert, dessen erster Schritt die Bildung eines Enzym-Substrat-Komplexes ist. Das Enzym wird dann wieder freigesetzt, entweder unverändert oder nach einer Modifikation zur Produktbildung:
| E + S « ES | ka, k'a |
| ES ® E +P | kb |
Mithilfe des Quasistationaritätsprinzips erhalten wir die Konzentration des Enzym-Substrat-Komplexes:
| d[ES] /dt = ka [E] [S] - k'a [ES] - kb [ES] = 0 |
Daraus folgt
| [ES] = (ka/(k'a+ kb)) [E] [S] = KM-1 [E] [S] |
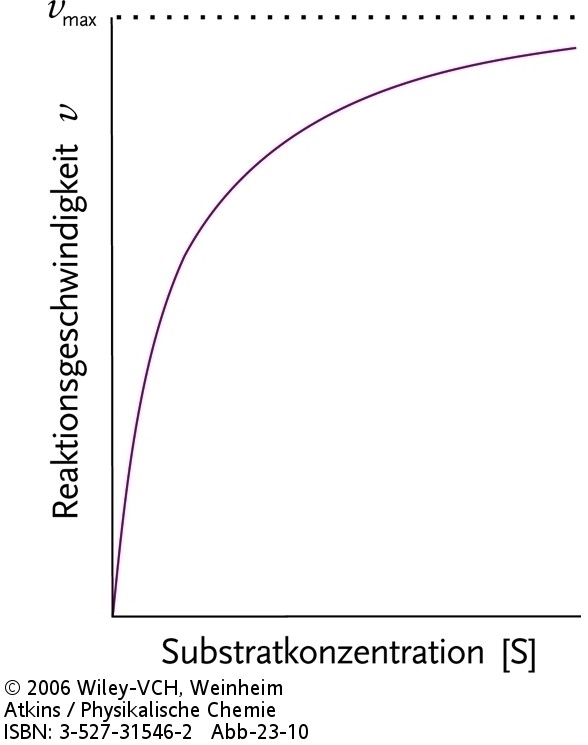 |
| Abb.1 Abhängigkeit der Geschwindigkeit einer enzymatischen Reaktion von der Konzentration des Substrats. |
Mit der Michaelis-Konstante (Definition beachten!):
| KM = ((k'a + kb)/ka) |
Die Einheit von KM ist die molare Konzentration . Um das Geschwindigkeitsgesetz anhand der Konzentration des zugefügten Enzyms und Substrats auszudrücken, überlegen wir zunächst, dass [E]0 = [E] + [ES] ist. Da außerdem das Substrat in der Regel in großem Überschuss relativ zum Enzym vorliegt, können wir die Konzentration des freien Substrats näherungsweise gleich der Anfangskonzentration des Substrats setzen, also [S] = [S]0. Damit ergibt sich
| [ES] = [E]0/(1 + KM/[S]0) |
Wenn wir diesen Ausdruck für [ES] in die Gleichung für die Geschwindigkeit der Produktbildung v = d[P] /dt = - d[ES] /dt = kb [ES] einsetzten, dann erhalten wir die Michaelis-Menten-Gleichung
| v = (kb [E]0)/(1 + KM/[S]0) |
Für [S]0 ®¥ erreicht die Geschwindigkeit v einen Maximalwert und hängt nicht mehr von [S]0 ab:
| vmax = kb [E]0 |
Diesen Ausdruck können wir in eine Form bringen, die zur Datenauswertung durch lineare Regression geeignet ist:
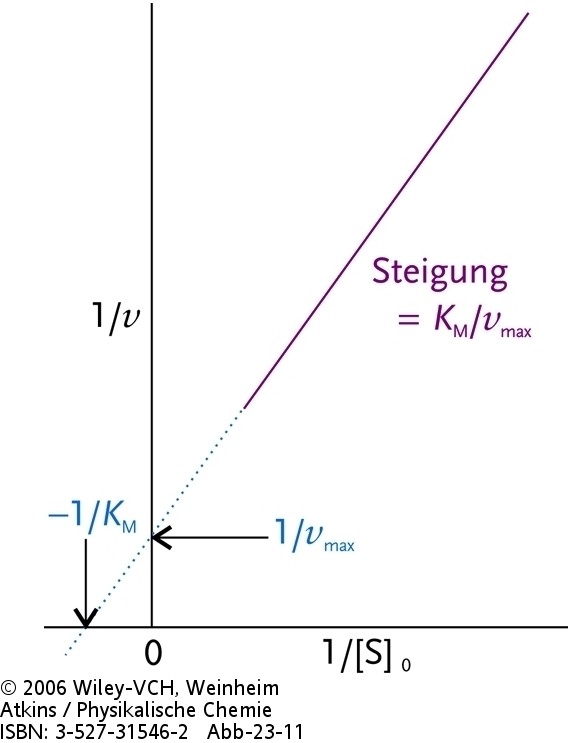 |
| Abb.2 Lineweaver-Burk-Diagramm zur Analyse einer enzymkatalysierten Reaktion, die nach einem Michaelis-Menten-Mechnismus verläuft. |
| 1/v = 1/vmax + (KM/vmax) 1/[S]0 |
Die katalytische Effizienz
Als katalytische Effizienz e eines Enzyms bezeichnet man das Verhältnis kb/KM: je größer e ist, desto effizienter wirkt das Enzym. Die katalytische Effizienz können wir uns als die effektive Geschwindigkeit der enzymatischen Reaktion vorstellen. Aus KM = (k'a + kb)/ka folgt:
| e = kb/KM = (ka kb)/(k'a + kb) |
In der Biochemie wird kb häufig durch kcat beschrieben und (für Chemiker leicht irreführend) als Wechselzahl bezeichnet. Die katalytische Effizienz wird maximal , wenn kb >> k'a ist (e = ka). Weil ka die Geschwindigkeitskonstante für die Bildung eines Komplexes aus zwei Einheiten ist, die frei durch eine Lösung diffundieren, hängt die maximale Effizienz mit den maximalen Diffusionsgeschwindigkeiten von E und S in der Lösung zusammen. Der obere Grenzwert führt zu einer Geschwindigkeitskonstanten von etwa 108 - 109 dm3 mol-1 s-1 bei Raumtemperatur für Moleküle in der für Enzyme typischen Größe. Für das Enzym Katalase ist e = 4,0 x 108 dm3 mol-1 s-1. Das bedeutet, die Geschwindigkeit der katalysierten Reaktion ist ausschließlich durch die Diffusion bestimmt, weil die Reaktion praktisch sofort stattfindet, wenn Enzym und Substrat miteinander in Kontakt kommen (man nennt das auch perfekte Katalyse).
Das Enzym Katalase verringert den oxidativen Stress, indem es Wasserstoffperoxid (H2O2) durch Disproportionierung zu Sauerstoff (O2) und Wasser (H2O) umsetzt. Die Reaktion erfolgt in zwei Schritten. Im ersten Schritt wird Wasserstoffperoxid reduziert und das Enzym oxidiert.
H2O2 + Katalase(red.) ® H2O + Katalase(ox.)
Im zweiten Schritt wird Wasserstoffperoxid oxidiert und das Enzym reduziert.
H2O2 + Katalase(ox.) ® H2O + O2 + Katalase(red.)
Die Summengleichung lautet:
2 H2O2 ® 2 H2O + O2
Katalasen befinden sich in fast allen aerob lebenden Mikroorganismen, in Pflanzen und allen tierischen Zellen.
Man erhält kb, in der Biochemie Wechselzahl kcat genannt, durch Bestimmung der Aktivität (vmax) dividiert durch die Enzymkonzentration (mol/l) im Test. Sie hat die Dimension k-1 (s-1). Wechselzahlen bewegen sich im Bereich von etwa 0,5 (Lysozym) und 1.000.000 (Carboanhydrase). Der Quotient aus Wechselzahl (kcat) und Michaelis-Menten-Konstante (Km) beschreibt die katalytische Effizienz.
| Enzym | Substrat | Wechselzahl (kcat) [s-1] |
kcat / Km [s-1 mol-1 l] |
|---|---|---|---|
| Carboanhydrase | CO2 | 1.000.000 | 76.000.000 |
| " | HCO3- | 200.000 | 10.000.000 |
| Katalase | H2O2 | 10.000.000 | 400.000.000 |
| Acetylcholinesterase | AcCh | 750 | 50.000.000 |
| Urease | Harnstoff | 3.000 | 1.250.000 |
| Fumarase | Fumarat | 1150 | 5.560.000 |
| " | S-Malat | 600 | 700.000 |
| Kinasen | ATP | 1.000 | - |
| Trypsin, Chymotrypsin | Proteine | 100 - 1.000 | - |
| Dehydrogenasen | NADH, H+, FADH2 | 1.000 | - |
| DNA Polymerasen | DNA, NTP | 10 - 10.000 | - |
| - Pol I | " | 15 | - |
| - Pol III | " | 10.000 | - |
| Myosin ATPase | ATP | 100 | - |
| humane Aldolase A | Fructose-1,6-bisphosphat | 60 | 1.150.000 |
| " | Fructose-1-phosphat | 1,3 | 50 |
| humane Aldolase B | Fructose-1,6-bisphosphat | 13 | 1.100.000 |
| " | Fructose-1-phosphat | 11 | 3.000 |
| humane Aldolase C | Fructose-1,6-bisphosphat | 20 | 1.500.000 |
| " | Fructose-1-phosphat | 2,7 | 150 |
| Lysozym | Murein | 0,5 | - |
![]()
Auf diesem Webangebot gilt die Datenschutzerklärung der TU Braunschweig mit Ausnahme der Abschnitte VI, VII und VIII.