In den einfachsten Fällen ist es möglich, die Bildungs- oder
Zerfallsgeschwindigkeit der Ausgangs-, Zwischen- und Endprodukte einer
Reaktionsfolge mathematisch geschlossen abzuleiten. Die Bildung eines
Stoffes C aus A über ein Zwischenprodukt B als Folge zweier irreversibler
Prozesse 1. Ordnung
| k | k' | |||
| A | → | B | → | C |
soll als einfaches Beispiel eingehender diskutiert werden: Die Ausgangskonzentrationen
bei t = 0 seinen [A]o bzw. [B]o = 0 und [C]o
= 0. Für die Zerfalls- bzw. Bildungsgeschwindigkeiten müssen
wir dann ansetzten:
| d[A]/dt = − k [A] |
| d[B]/dt = k[A] − k'[B] |
| d[C]/dt = k'[B] |
Die Lösung für [A] kennen wir bereits:
| [A] = [A]o e−kt |
Die Konzentration [A] des Ausgangstoffes A nimmt wie bei jeder Reaktion
erster Ordnung exponentiell mit der Zeit ab. Für [B] ergibt sich damit
| d[B]/dt = k[A]o e−kt − k'[B] |
Das ist eine lineare Differentialgleichung erster Ordnung, die sich mit Hilfe der Lagrangeschen Methode der Variation der Konstanten lösen lässt:
Wir integrieren zunächst die homogene Differentialgleichung
d[B]/dt + k' [B] = 0
Dann setzen wir als Lösung für die inhomogene Differentialgleichung an
[B] = c(t) e−k' t
und erhalten für die von t abhängige Größe c(t)
c(t) = − k[A]o/k−k'· e−(k−k')t + konst
so dass die allgemeine Lösung nach Berücksichtigung der
Anfangsbedingungen lautet
| [B] = k[A]o/k'−k(e−k t − e−k' t) |
Die Konzentration [C] des Endprodukts C erhalten wir aus der Bilanz
[A]o = [A] + [B] + [C]
| [C] = [A]o (1 −k'/k'−k e−k t + k/k'−k e−k1't) |
 |
 |
 |
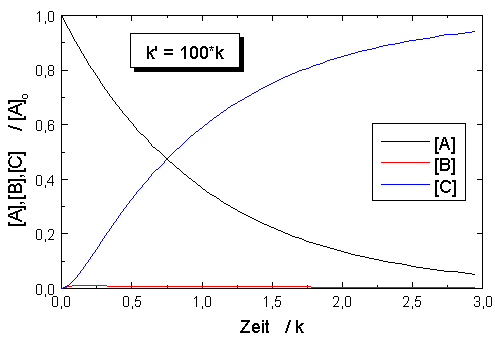 |
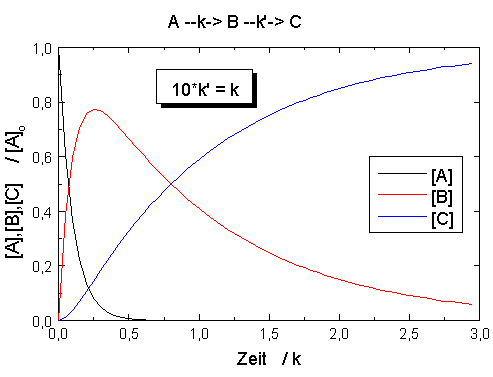
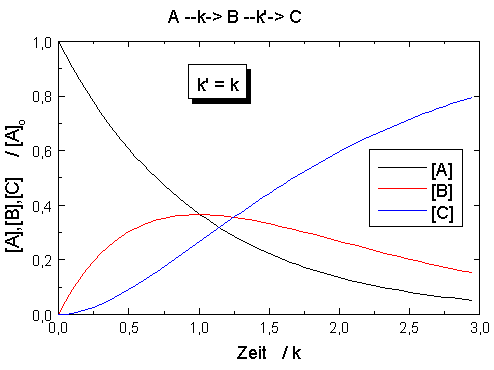
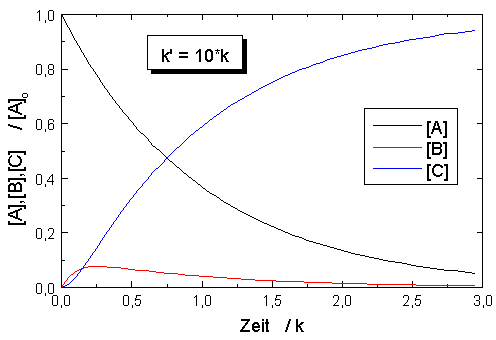
| Abb.1: Zeitlicher Verlauf für den
Prozess A →
B → C mit den Geschwindigkeitskonstanten k bzw. k'. Anfangsbedingungen sind [A]o aber [B]o = [C]o = 0. |
|
In der Abbildung sind die Konzentrationen des Ausgangsstoffes [A], des Zwischenprodukts [B] und des Endprodukts [C] für eine Ausgangskonzentration [A]o = 1 mol·dm-3 und verschiedene Verhältnisse der Geschwindigkeitskonstanten k und k'. Der Vergleich der Abbildungen zeigt, dass bei einem großen Wert des Verhältnisses k/k' das Ausgangsprodukt A schnell abgebaut wird und das Zwischenprodukt B intermediär in hoher Konzentration auftritt, während bei einem kleinen Wert dieses Verhältnis A nur langsam verbraucht wird und B nur in geringerer Konzentration vorliegt. Der zeitliche Verlauf der Konzentration des Endproduktes C ändert sich nicht, wenn die Werte von k und k' vertauscht werden, wie auch aus der Gleichung für C hervorgeht. Ein Vergleich der Abbildungen lässt auch erkennen, wie sich bei festgehaltenen Werten von [A]o und k eine Veränderung von k' auf den zeitlichen Konzentrationsverlauf von B und C auswirkt: Durch eine Verringerung von k' verschiebt sich das Auftreten der Maximalkonzentration von B nach größerer Reaktionszeit und die Induktionszeit bis zum Auftreten merklicher Mengen an Reaktionsprodukt C wird deutlicher.
Als Beispiel für eine Folge von zwei Reaktionen erster Ordnung kann der thermische Zerfall von Aceton dienen, der nach Winkler und Hinshelwood über die Stufen
| O | ||||||||||
| | | | ||||||||||
| CH3 | − | C | − | CH3 | → | CH2 | = | CO | + | CH4 |
| CH2 | = | CO | → | ½ | C2H4 | + | CO |
| [C] = [A]o · (1 − e−k' t) wenn k >> k' |
| [C] = [A]o · (1 − e−k t) wenn k << k' |
Der Reaktionsablauf wird dann allein durch die langsamere der beiden Folgereaktionen bestimmt, die Zeitabhängigkeit der Konzentration [C] entspricht einer Reaktion erster Ordnung.
![]()
Auf diesem Webangebot gilt die Datenschutzerklärung der TU Braunschweig mit Ausnahme der Abschnitte VI, VII und VIII.