Das Sonnenlicht entspricht der Strahlung eines schwarzen Körpers bei der (Sonnenoberflächen-) Temperatur von 8700 K. Bei dieser Temperatur wird auch Licht sehr hoher Frequenz bzw. niedriger Wellenlänge λ = c/ν emittiert. Die Moleküle der Erdatmosphäre absorbieren bei einer charakteristischen Wellenlänge (bzw. Frequenz) Licht, das dann den Erdboden nicht mehr erreicht. In diesem Zusammenhang interessiert uns besonders das Licht bei Wellenlängen unterhalb von 310 nm. Extrem kurzwelliges Licht, wovon die Sonne relativ wenig abstrahlt, ionisiert die Moleküle und Atome im obersten Atmosphärenbereich, was zur Ausbildung der Ionosphäre führt. Bei Wellenlängen oberhalb von 100 nm absorbieren Stickoxide die Sonnenstrahlung und bis ca. 240 nm wird das Sonnenlicht von Sauerstoff vollständig absorbiert. Oberhalb dieser Wellenlänge bis ca. 310 nm gibt es nur noch eine Spezies, die verhindert, dass diese UV-Strahlung die Erdoberfläche erreicht: Das Ozon. Gäbe es das O3-Molekül nicht, dann sähe es schlecht um die Zukunft des Menschengeschlechts (und fast aller Tierarten) aus, denn die UV-Strahlung würde in den biologischen Zellen eine Photochemie initiieren, die schließlich zum Hautkrebs führen würde.
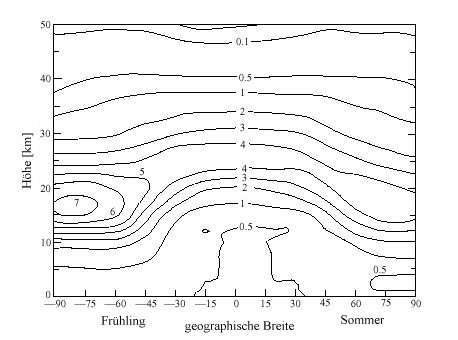 |
| Abb. 1: Linien gleicher Ozonkonzentration [1012 Moleküle/cm³] für unterschiedliche geographische Breiten und als Funktion der Höhe |
Wir wollen uns nun anhand des Ozons einige Prinzipien der Photochemie klar machen. Zunächst schreiben wir in "chemischer Manier" die Reaktionsgleichung für die Lichtabsorption auf:
O3 + hν → O2 + O
Dies bedeutet, dass bei Absorption eines Lichtquants (hν) durch ein Ozonmolekül dieses in die beiden Fragmente Sauerstoffmolekül und -atom zerfällt. Wie dies im Einzelfall geschieht muss die so genannte Photodissoziationsdynamik aufklären.
![]()
Auf diesem Webangebot gilt die Datenschutzerklärung der TU Braunschweig mit Ausnahme der Abschnitte VI, VII und VIII.