Elektrodenreaktionen und Galvanische Zellen
![]()
Man bezeichnet eine chemische Reaktion als Oxidation, bei der eine Spezies Elektronen entzogen, und als Reduktion, bei der einer Spezies Elektronen hinzugefügt werden. Bei einer Redoxreaktion werden Elektronen von einer Spezies auf eine andere übertragen. Gleichzeitig mit dem Elektronentransfer können andere Vorgänge, wie der Austausch von Ionen oder Atomen stattfinden; der wichtigste Effekt einer Redoxreaktion ist jedoch die Elektronenübertragung, die eine Änderung der Oxidationszahlen der beteiligten Spezies bewirkt. Das Reduktionsmittel ist dabei der Elektronendonator, das Oxidationsmittel der Elektronenakzeptor.
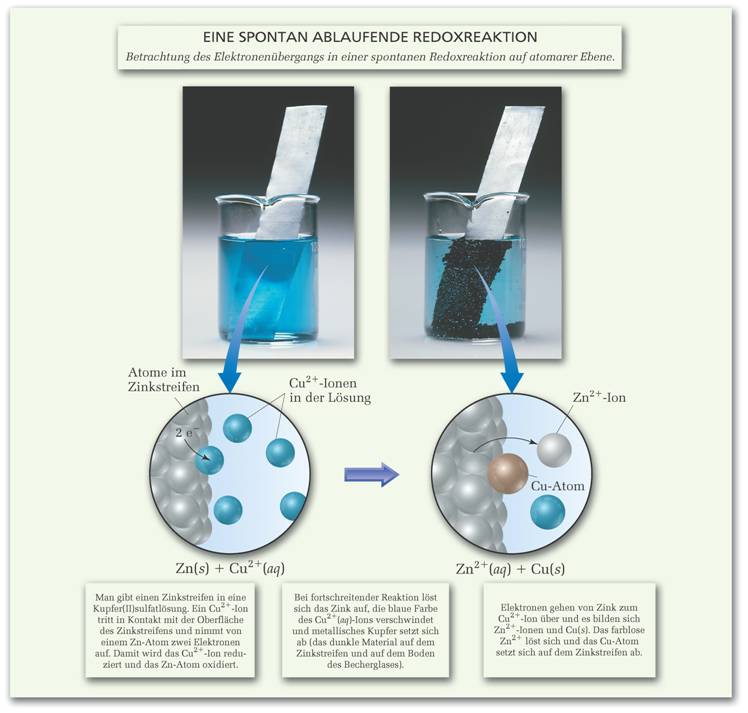 |
| Abb. 1: Spontan ablaufende Redoxreaktion (aus "Chemie", Pearson Studium) |
Man erhält eine spontan ablaufende Redoxreaktion, wenn man
einen Zinkstreifen in eine Lösung mit Cu2+-Ionen eintaucht. Bei
fortschreitender Reaktion verblasst die blaue Farbe des Cu2+(aq)-Ions
und metallisches Kupfer setzt sich auf dem Zink ab. Dabei löst sich das Zink
auf. Diese Vorgänge sind in der Abbildung 1 dargestellt und in der Gleichung
Zn(s) + Cu2+(aq) → Zn2+(aq) + Cu(s)
zusammengefasst.
In den Abbildungen 2 und 3 ist jeweils eine galvanische Zelle zu sehen, die mit Hilfe dieser Redoxreaktion von Zn mit Cu2+ arbeitet. Der Versuchsaufbau ist in Abbildung 2 und 3 komplexer als in Abbildung 1, aber die Reaktion ist in beiden Fällen gleich. Der entscheidende Unterschied zwischen den beiden Experimenten liegt darin, dass in der galvanischen Zelle kein direkter Kontakt zwischen dem elementaren Zink und den Cu2+(aq)-Ionen besteht: In der einen Abteilung der Zelle steht das metallische Zn in Kontakt mit den Zn2+(aq) -Ionen und im anderen Teil befinden sich das elementare Kupfer und die Cu2+(aq)-Ionen. Folglich kann die Reduktion von Cu2+ nur dann stattfinden, wenn sich Elektronen auf einem externen Weg verschieben; in diesem Fall fließen sie durch das Kabel, das den Zn- und Cu-Streifen verbindet. In anderen Worten, wir trennen physikalisch die Reduktions- und die Oxidations-Halbreaktion und erzwingen damit einen Elektronenfluss in einem externen Stromkreis.
 |
| Abb. 2: Eine galvanische Zelle, die im linken Becherglas CUSO4 und eine Kupferelektrode enthält und im rechten Becherglas ZnSO4 und eine Zinkelektrode. Die Lösungen sind über eine poröse Glaswand verbunden, so dass ein ionenaustausch möglich ist. (Quelle s. Abb.1) |
Die beiden Metalle, die man durch diesen Stromkreis verbindet, heißen Elektroden. Man definiert die Elektrode, an welcher die Oxidation abläuft, als Anode und die Elektrode der Reduktionsreaktion als Kathode.
| Kleine Merkregel: |
| Die Werte Anode und Oxidation beginnen beide mit einem Vokal, Kathode und Reduktion beide mit einem Konsonanten. |
Wie im vorliegenden Beispiel können die Elektroden auch aus Material bestehen, die an der Reaktion beteiligt sind. Bei fortschreitender Reaktion wird die Zinkelektrode langsam verbraucht und die Masse der Kupferelektrode nimmt zu. Häufiger stellt man die Elektroden aus leitendem Material wie Platin oder Graphit her, das Elektronenübergänge während der Reaktion zulässt, ohne dabei Masseveränderungen zu erleiden.
Die beiden Abteilungen einer galvanischen Zelle heißen Halbzellen. In der einen Halbzelle findet die Oxidations-Teilreaktion statt und in der anderen Halbzelle entsprechend die Reduktions-Teilreaktion. in unserem Beispiel wird Zn oxidiert und Cu2+ reduziert:
| Anode (Oxidations-Halbreaktion): | Zn(s) → Zn2+(aq) + 2e- |
| Kathode (Reduktions-Halbreaktion): | Cu2+(aq) + 2e- → Cu(s) |
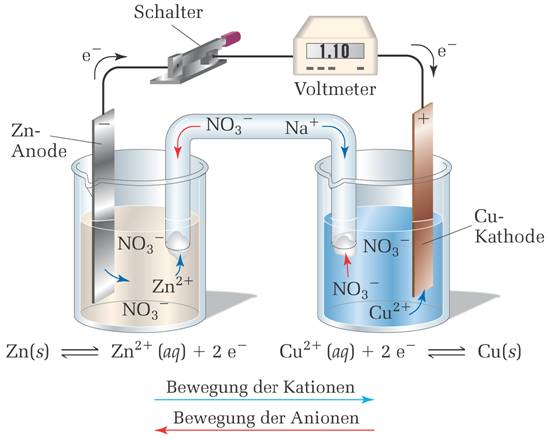 |
| Abb. 3: Eine Salzbrücke als Verbindung der Bechergläser. (Quelle s. Abb.1) |
Die Oxidation von metallischem Zink an der Anode setzt Elektronen frei, die durch den externen Stromkreis zur Kathode fließen, wo sie bei der Reduktion von Cu2+(aq) aufgenommen werden. Im Laufe dieses Vorgangs in der galvanischen Zelle nimmt die Masse der Zinkelektrode ab, da das Zn(s) oxidiert wird, und die Konzentration der Zn2+-Lösung steigt an. Umgekehrt nimmt die Masse der Cu-Elektrode zu und die Konzentration der Cu2+-Lösung sinkt, den Cu2+ wird zu Cu(s) reduziert.
Die Lösungen in beiden Halbzellen müssen elektrisch neutral bleiben, um die galvanische Zelle betriebsfähig zu erhalten. Durch die Oxidation von Zn an der Anode gehen Zn2+-Ionen in Lösung. Daher muss für die positiven Ionen die Möglichkeit bestehen, die Abteilung der Anode zu verlassen, oder negative Ionen müssen hinzu wandern können, um die Lösung elektrisch neutral zu erhalten. Analog entzieht die Reduktion der Cu2+-Ionen an der Kathode der Lösung positive Ladungen und verursacht damit einen Überschuss an negativen Ladungen in dieser Halbzelle. Folglich müssen positive Ionen in diese Halbzelle eintreten oder negative Ionen abfließen. Ein messbarer Elektronenfluss zwischen den Elektroden findet erst dann statt, wenn es den gelösten Ionen möglich ist, von der einen Halbzelle zur anderen zur wandern und damit den Stromkreis zu schließen.
In der Abbildung 2 bleibt die elektrische Neutralität der Lösung erhalten, da eine poröse Glasscheibe als Trennwand den Fluss von Ionen zwischen beiden Halbzellen zulässt. In Abbildung 3 übernimmt eine Salzbrücke diese Funktion. Die Salzbrücke besteht aus einem U-förmigen Rohr, das eine Elektrolytlösung wie beispielsweise NaNO3(aq) enthält, deren Ionen nicht mit den anderen Ionen der Zelle oder mit den Materialien der Elektrode reagieren. Während die Oxidation und Reduktion an den Elektroden fortschreiten, bewegen sich Ionen über die Salzbrücke und gleichen somit die Ladungen in den beiden Abteilungen der Zelle aus. Über welches Medium auch immer sich die Ionen zwischen den Halbzellen bewegen, die Anionen fließen immer in Richtung Anode und die Kationen in Richtung Kathode.
Eine molekulare Betrachtung der Prozesse an der Elektrode
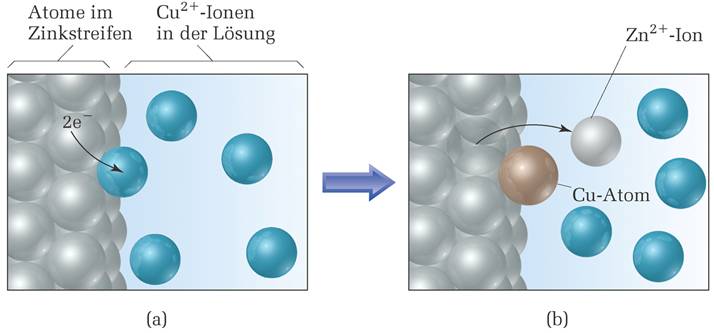
|
| Abb. 4 (oben) und Abb.5 (unten): Darstellung der Zn-Cu2+-Reaktion auf atomarer Ebene. (Quelle s. Abb.1) |
In Abbildung 4 ist ein schematisches Diagramm der Abläufe in Abb. 1 auf der atomaren Ebene gegeben. Stellen wir uns ein Cu2+-Ion vor, dass wie in Abbildung 4a mit dem Streifen aus metallischem Zink in Berührung tritt. Vom Zn-Atom gehen zwei Elektronen zum Cu2+-Ion über und es bilden sich ein Zn2+-Ion und ein Cu-Atom. Das Zn2+-Ion geht in wässrige Lösung über, während das Cu-Atom sich am Metallstreifen absetzt. (Abb. 4b). Bei fortschreitender Reaktion entsteht mehr und mehr Cu(s)- und die Cu2+(aq)-Ionen werden aufgebraucht.
Die galvanische Zelle in Abbildung 3 basiert ebenfalls auf der Oxidation von Zn(s) und der Reduktion von Cu2+(aq). In diesem Fall läuft jedoch kein direkter Elektronentransport zwischen den reagierenden Substanzen ab. Abbildung 5 veranschaulicht qualitativ die Vorgänge an den Elektroden. Ein Zinkatom gibt zwei Elektronen an die Oberfläche der Anode ab und verwandelt sich in ein Zn2+(aq)-Ion. Wir können uns die beiden Elektronen auf ihrem Weg durch das Kabel von der Anode zur Kathode vorstellen. An der Kathodenoberfläche reduzieren die beiden Elektronen das Cu2+-Ion zu einen Cu-Atom, dass sich an der Kathodenoberfläche absetzt. Wie wir bereits feststellten, kommt dieser Elektronenfluss von der Anode zur Kathode nur dann in Gang, wenn Ionen die Salzbrücke durchdringen können und damit Ladungsausgleich in beiden Halbzellen herstellen.
Die Redoxreaktion von Zn und Cu2+ läuft sowohl bei Direktkontakt als auch über die getrennten Abteilungen einer galvanischen Zelle spontan ab. Die Gesamtreaktion ist in beiden Fällen gleich; es unterscheiden sich lediglich die Wege der Elektronen vom Zn- zum Cu2+-Ion. Im nächsten Abschnitt werden wir untersuchen, warum diese Reaktion spontan abläuft.
![]()
Auf diesem Webangebot gilt die Datenschutzerklärung der TU Braunschweig mit Ausnahme der Abschnitte VI, VII und VIII.