Das Standardpotential
![]()
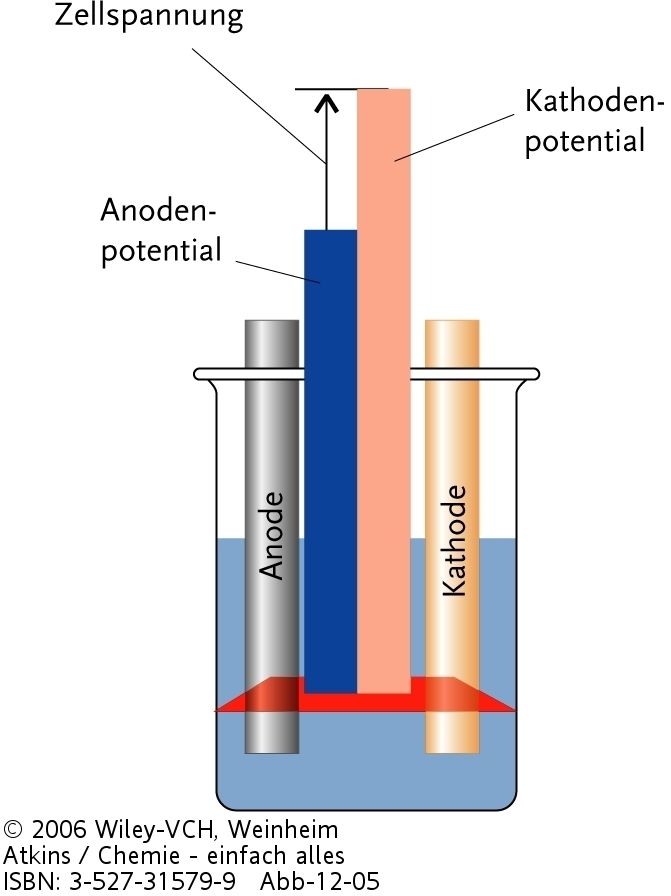 |
| Abb. 1: Die EMK einer Zelle ist die Differenz zweier Elektrodeneinzelpotentiale. |
Es gibt vielfältigste Möglichkeiten, galvanische Zellen aufzustellen und zu untersuchen. Viel einfacher als alle unterschiedlichen Zelltypen zu lernen ist es jedoch, sich auf die Elektroden zu beschränken, aus denen die Zellen aufgebaut werden können. Jede Elektrode gibt der Zelle unter Standardbedingungen [d.h. gelöste Stoffe bei 1 mol L-1; Gase bei 1 bar (105 Pa)] ein charakteristisches Standardpotential E0. Jedes Standardpotential stellt ein Maß für die elektronenziehende Kraft der Elektrode dar. In einer galvanischen Zelle ziehen die Elektroden in verschiedene Richtungen, so dass die Gesamtzugkraft, die Standard-EMK der Zelle, die Differenz der Standardpotentiale der beiden Elektroden ist (s. Abb. 1). Diese Differenz wird immer angegeben als
E0 = E0R (rechte Elektrode im Zelldiagramm) - E0L (linke Elektrode im Zelldiagramm)
Wenn E0 > 0, läuft unter Standardbedingungen die entsprechende Zellreaktion spontan ab, und die Elektrode rechts im Diagramm ist die Kathode. Wäre E0 < 0, dann müssten wir folgern, dass unter Standardbedingungen die umgekehrte Zellreaktion spontan abläuft.
Für alle Standardpotentiale könnten wir eine Liste erstellen. Allerdings haben wir dann das Problem, dass wir nur die Gesamt-EMK der Zelle kennen, nicht jeden einzelnen Elektrodenbeitrag. Ein Spannungsmesser zwischen den beiden Elektroden einer galvanischen Zelle misst die Potential-Differenz, nicht die individuellen Werte. Um nun einzelne Standardpotentiale als numerischen Wert zu erhalten, setzen wir willkürlich das Standardpotential von einer bestimmten Elektrode, der Wasserstoffelektrode, bei allen Temperaturen auf Null:
2 H+(g) + 2 e- → H2(g) E0 = 0
In Redoxpaar-Schreibweise bedeutet das E0 (H+/H2) = 0 bei allen Temperaturen. Wenn die Wasserstoffelektrode im Standardzustand vorliegt, d. h, gasförmiger Wasserstoff bei 105 Pa und Wasserstoffionen bei 1 mol L-1 (streng genommen einen Aktivitätseinheit), haben wir die Standard-Wasserstoffelektrode (standard hydrogen Electrode, SHE). Mit der Standard-Wasserstoffelektrode als Referenz können dann die Standardpotentiale von allen anderen Elektroden definiert werden:
|
Das Standardpotential eines Redoxpaares ist gleich der Standard-EMK einer Zelle (einschließlich ihres Vorzeichens), wobei die Elektrode rechts im Zelldiagramm das Redoxpaar darstellt und die Elektrode links im Zelldiagramm die Wasserstoffelektrode ist. |
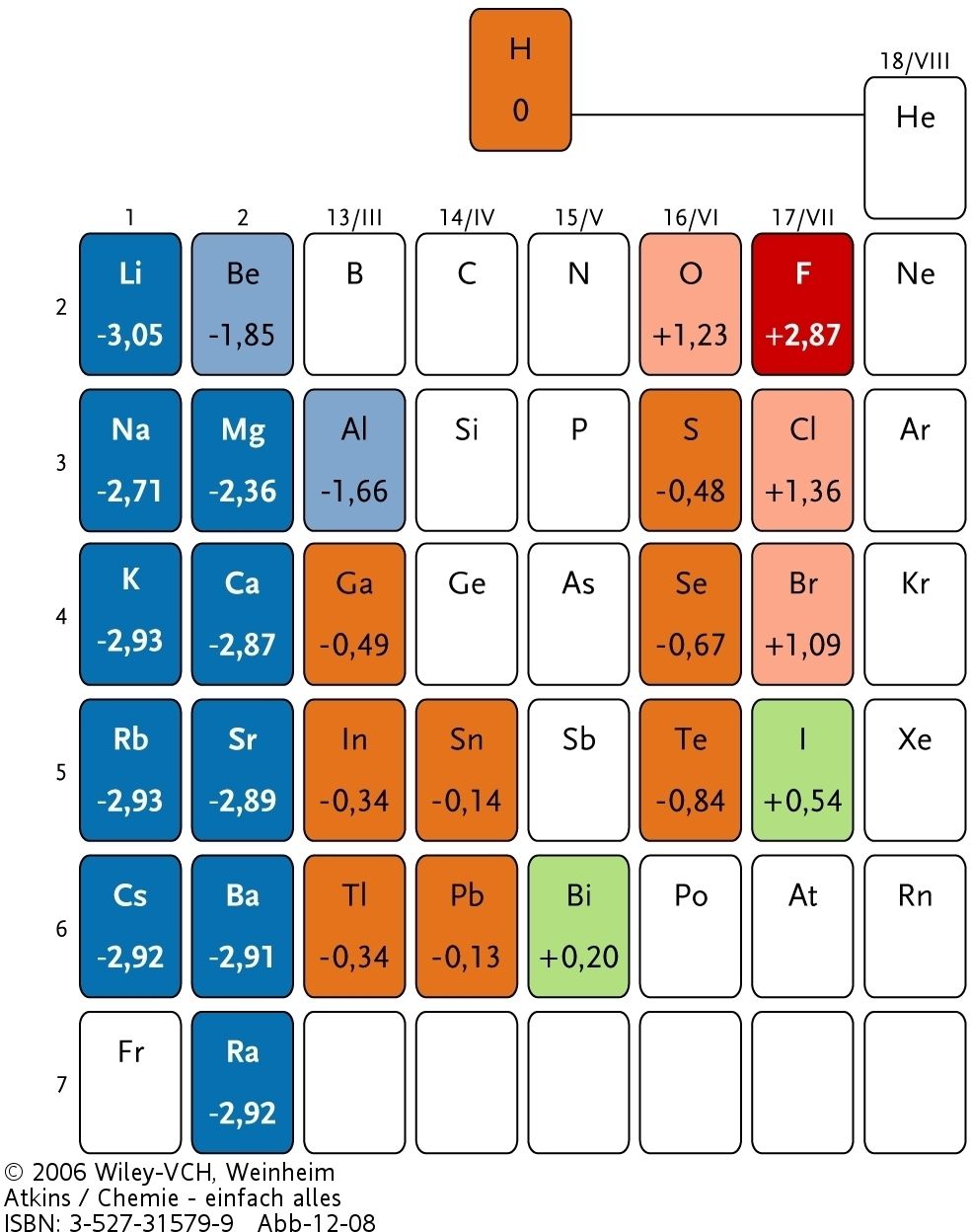 |
| Abb. 2: Die Standardpotentiale der Hauptgruppen des Periodensystems. |
In Tabelle 1 sind eine Reihe von Standard-Elektrodenpotentialen bei 25°C (der einzigen hier betrachteten Temperatur) aufgeführt. Die am stärksten negativen Potentiale - also die Elemente mit der stärksten Reduktionskraft - liegen am linken Rand des Periodensystems. Die am höchsten postiven Potentiale - die Elemente mit der stärksten Oxidationskraft - sind rechts oben im Periodensystem zu finden.
| Tabelle 1: Standardpotentiale bei 25 °C | ||
| Spezies | Reduktions-Halbreaktion | E0 (V) |
| Oxidierte Form ist stark oxidierend | ||
| F2/F- | F2(g) + 2 e- → 2 F-(aq) | +2,87 |
| Au+/Au | Au+(aq) + e- → Au(s) | +1,69 |
| Ce4+/Ce3+ | Ce4+(aq) + e- → Ce3+(aq) | +1,61 |
| MnO4-, H+/Mn2+, H2O | MnO4-(aq) + 8 H+(aq) + 5 e- → Mn2+(aq) + 4 H2O(l) | +1,51 |
| Cl2/Cl- | Cl2(g) + 2 e- → 2 Cl-(aq) | +1,36 |
| Cr2O72-, H+/Cr3+, H2O | Cr2O72-(aq) + 14 H+(aq) + 6 e- → 2 Cr3+(aq) + 7 H2O(l) | +1,33 |
| O2, H+/H2O | O2(g) + 4 H+(aq) + 4 e- → 2 H2O(l) | +1,23; +0,82 bei pH = 7 |
| Br2/Br- | Br2(l) - 2 e- → 2 Br-(aq) | +1,09 |
| NO3-, H+/NO, H2O | NO3-(aq) + 4 H+(aq) + 3 e- → NO(g) + 2 H2O(l) | +0,96 |
| Ag+/Ag | Ag+(aq) + e- → Ag(s) | +0,80 |
| Fe3+/Fe2+ | Fe3+(aq) + e- → Fe2+(aq) | +0,77 |
| I2/I- | I2(s) + 2 e- → 2 I-(aq) | +0,54 |
| O2, H2O/OH- | O2(g) + 2 H2O(l) + 4 e- → 4 OH-(aq) | +0,40; +0,82 bei pH = 7 |
| Cu2+/Cu | Cu2+(aq) + 2 e- → Cu(s) | +0,34 |
| AgCl/Ag, Cl- | AgCl(s) + e- → Ag(s) + Cl-(aq) | +0,22 |
| H+/H2 | 2 H+(aq) + 2 e- → H2(g) | 0, per Definition |
| Fe3+/Fe | Fe3+(aq) + 3 e- → Fe(s) | -0,04 |
| O2, H2O/HO2-, OH- | O2(g) + H2O(l) + 2 e- → HO2-(aq) + OH-(aq) | -0,08 |
| Pb2+/Pb | Pb2+(aq) + 2 e- → Pb(s) | -0,13 |
| Sn2+/Sn | Sn2+(aq) + 2 e- → Sn(s) | -0,14 |
| Fe2+/Fe | Fe2+(aq) + 2 e- → Fe(s) | -0,44 |
| Zn2+/Zn | Zn2+(aq) + 2 e- → Zn(s) | -0,76 |
| H2O/H2, OH- | 2 H2O(l) + 2 e- → H2(g) + 2 OH-(aq) | -0,83; -0,42 bei pH = 7 |
| Al3+/Al | Al3+(aq) + 3 e- → Al(s) | -1,66 |
| Mg2+/Mg | Mg2+(aq) + 2 e- → Mg(s) | -2,36 |
| Na+/Na | Na+(aq) + e- → Na(s) | -2,71 |
| K+/K | K+(aq) + e- → K(s) | -2,93 |
| Li+/Li | Li+(aq) + e- → Li(s) | -3,05 |
| Reduzierte Form ist stark reduzierend | ||
![]()
Auf diesem Webangebot gilt die Datenschutzerklärung der TU Braunschweig mit Ausnahme der Abschnitte VI, VII und VIII.