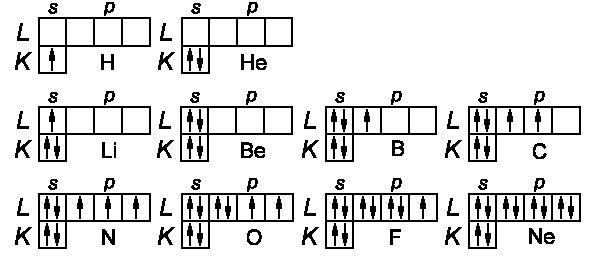

Wasserstoff:
z = 1
| n |
|
|
|||
| L | 2 | ||||
| K | 1 |
|
H | ||
Ein Elektron (1s), daher Grundzustand 2S½
Bindungsenergie (Ionisierungsenergie) ist 13,6 eV
Helium:
z = 2
| n |
|
|
|||
| L | 2 | ||||
| K | 1 | Ýß | He | ||
2 Elektronen (1s) (1s), Kurzbezeichnung 1s2
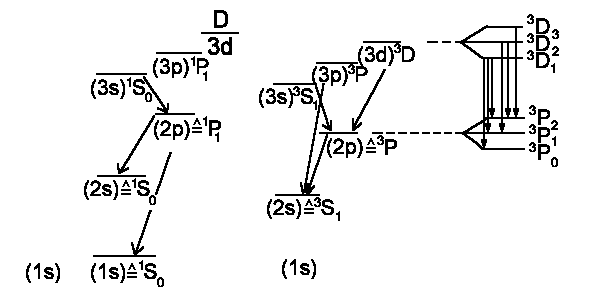
Da beide Elektronen nicht durch die gleiche Quantenzahlen repräsentiert werden können, muss der Grundzustand 1S0 sein (Gesamtspin S = + ¯ = 0). Wenn wir ein Elektron in den n = 2, d.h. 2s Zustand anregen, also (1s) (2s), dann unterschieden sich die beiden Elektronen durch die Hauptquantenzahl n und der Gesamtspin kann auch S = 1 betragen. Wir können so qualitativ das Energieniveauschema und die möglichen Übergänge von He zeichnen:
Lithium:
z = 3
| n |
|
|
|||
| L | 2 | Ý | |||
| K | 1 | Ýß | Li | ||
Dank Pauli gibt es keine 1s3 Konfiguration, sondern
1s2 2s º 2S½.
- abgeschlossenen Schale mit L = 0
und S = 0, also J = 0.
Wäre durch die zwei 1s Elektronen der Kern vollständig abgeschirmt, dann betrüge die Ionisierungsenergie 13,6 eV/4 = 3,4 eV. Da jedoch auch die 2s Wellenfunktion bis in den Kern "hineinragt", ist die Ionisierungsenergie von Li etwas höher: 5,4 eV oder Zeff = 1,3.
Da die erste Schale 1s2 abgeschlossen, d.h. voll besetzt
ist und dem Edelgas Helium entspricht, schreibt man häufig He(2s)
für die Li-Grundzustandskonfiguration. Eine andere Schreibweise benutzt
die großen Buchstaben K, L, M, N.... für die abgeschlossenen
Schalen, also K(1s) für Li.
Beryllium:
z = 4
| n |
|
|
|||
| L | 2 | Ýß | |||
| K | 1 | Ýß | Be | ||
(1s2) (2s2) ≡1S0
Die Bindungsenergie wäre 24,6 eV/4
= 6,2 eV (24,6 eV ≡ He) Wegen unvollständiger
Abschirmung ergibt sich 9,3 eV. Da ein 2p-Orbital energetisch nur ein wenig
höher liegt, kann die geschlossenen Schale sehr leicht "aufgebrochen"
werden, so dass Be nicht so chemisch inert ist wie He.
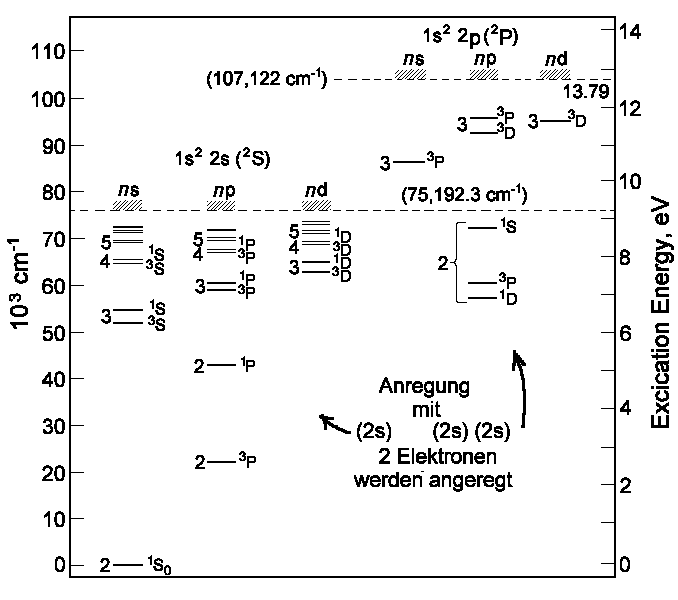 |
| Energiezustände des Berylliums |
Bor:
z = 5
| n |
|
|
|||
| L | 2 |
|
Ý | ||
| K | 1 | Ýß | B | ||
(1s2) (2s2) (2p) ≡2P½
Prinzipiell könnte auch ein 2P3/2 als Grundzustand möglich sein, der 2P½-Zustand liegt jedoch energetisch etwas tiefer (Hund'sche Regel (2)); erklärbar über
![]()
Auf diesem Webangebot gilt die Datenschutzerklärung der TU Braunschweig mit Ausnahme der Abschnitte VI, VII und VIII.