Für eine erfolgreiche Kombination beliebiger Atome A und B der Art y = cAφA + cBφB müssen die Funktionen φA und φB bzgl. der Molekülachse die gleiche Symmetrie aufweisen. Diese Bedingung folgt aus der Tatsache, dass keine Kombination von φA und φB möglich ist, wenn aus irgendwelchen Gründen S = 0 und somit β = 0 ist, denn dann gibt es zwei unabhängige Gleichungen mit den Lösungen E = αA, y = φA und E = αB, y = φB. Dieser Fall kann eintreten, wenn sich zwei Orbitale überhaupt nicht überlappen, oder wenn es gewisse Symmetrieeigenschaften von φA und φB ermöglichen, jedes Integral S und β in zwei betragsgleiche Teile, aber mit entgegengesetzten Vorzeichen, zu zerlegen. In diesem Fall können wir sagen, dass φA und φB aus Symmetriegründen nicht miteinander kombinieren, und deshalb gibt es auch kein MO, in dem beide Funktionen gemeinsam auftreten.
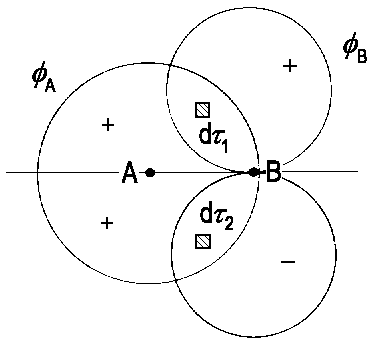 |
| Das Integral òfAφBdt verschwindet symmetriebedingt, da es zu jedem Volumenelement dτ1 ein entsprechendes Element dτ2 gibt, so dass die Integranden in den beiden Elementen zwar betragsgleich sind, aber entgegengesetzte Vorzeichen haben. |
Ein Beispiel dafür ist in der Abbildung symbolisch dargestellt, wobei φA ein s-AO, φB ein px-AO und die x-Achse senkrecht zur Molekülachse AB gewählt ist. Nach Konvention wird die Molekülachse in die z-Achse gelegt. Aus der Abbildung folgt, dass das Integral S = òfAφBdτ = 0 ist, wobei der Unterschied im Vorzeichen für die beiden Lappen des px-Orbitals entscheidend ist. Zu jedem kleinen Volumenelement dτ1 gibt es ein entsprechendes Element dτ2, so dass die Integranden in den beiden Elementen betragsgleich sind, aber entgegengesetzte Vorzeichen haben. Wir können deshalb sagen, dass das Integral symmetriebedingt verschwindet. Sind die Funktionen φA und φB vom s-Typ und vom px-Typ, so gilt S = 0, unabhängig von den speziellen Formen dieser beiden Funktionen. Es ist unmittelbar einleuchtend, dass ein px-AO an einem Atom nicht mit einem px-AO oder s-AO am anderen Atom kombinieren kann.
Ist das Integral òfAφBdτ gleich Null, so nennen wir die Wellenfunktionen φA und φB zueinander orthogonal. Sind φA und φB Orbitale verschiedener Symmetrie (etwa bei unterschiedlichen Verhalten bezüglich einer Spiegelung an einer Symmetrieebene), so sind sie orthogonal.
Mögliche Kombinationen von Atomorbitalen vom s-Typ, p-Typ und d-Typ
sind in der folgenden Tabelle aufgeführt:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
In späteren Kapiteln werden Beispiele gegeben für die gleichzeitige Kombination eines Atomorbitals φA mit zwei oder mehr Atomorbitalen φB am Kern B. Mögliche Kombinationen können aus der obigen Tabelle Rubrik "kombiniert mit φB", entnommen werden. Da wir als Molekülachse die z-Achse gewählt haben, ist es zweckmäßig, die folgenden fünf d-Orbitale zu verwenden: dxy, dyz, dzx, dz², dx²-y².
![]()
Auf diesem Webangebot gilt die Datenschutzerklärung der TU Braunschweig mit Ausnahme der Abschnitte VI, VII und VIII.