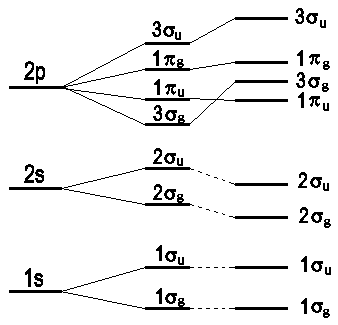
Wollen wir wie bei den Atomen auch für die Molekülstruktur ein Aufbauprinzip einführen, so müssen wir die energetische Reihenfolge aller Orbitale kennen. Nach heutigen Erkenntnissen lautet diese Reihenfolge
|
|
Dabei ist zu beachten, dass jedes π-MO
zweifach entartet ist. Beispielsweise können wir unter dem 1πu-MO
das Paar 1πxu, 1πyu
verstehen, das den Aufbau aus px- und py-AO deutlich
macht. Bei zweiatomigen Molekülen mit Atomen aus der zweiten Reihe
des Periodensystems liegt σg immer
unterhalb von πu.
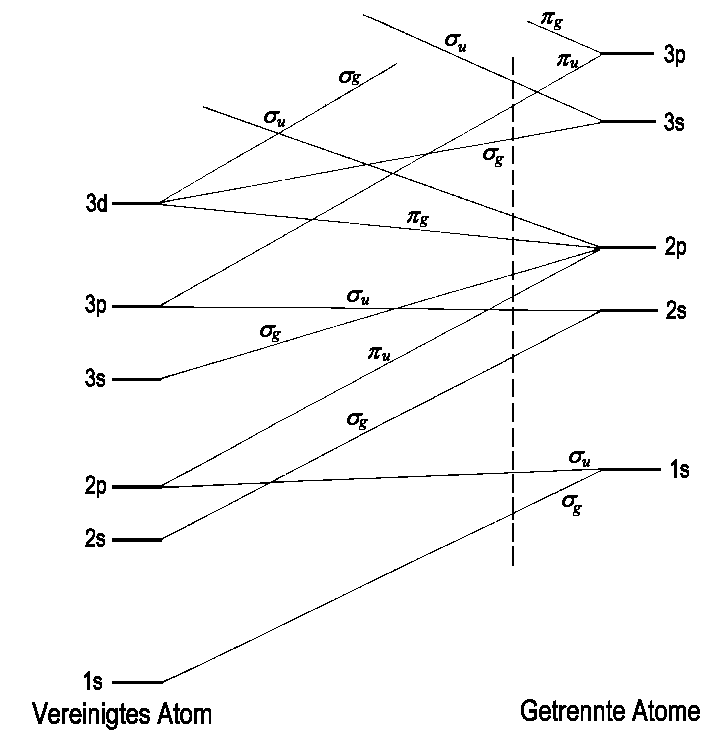 |
| Abb.1: Bestimmung der relativen Lage von MO-Energieniveaus durch ein Korrelations- diagramm. Bei dem Abstand, der durch die senkrechte Linie angedeutet ist, wird die energetische Folge der Niveaus bestimmt. |
Die geraden Linien, die die Orbitale auf den beiden Seiten miteinander
verbinden, deuten solche Korrelationen an und geben dabei die Richtungen
an, in die sich die Energieniveaus bewegen, wenn sich der interatomare
Abstand ändert. Es ist darauf zu achten, dass bei der Herstellung
solcher Diagramme die Entkreuzungsregel nicht verletzt wird, d.h.
jede Kreuzung muss zwischen Zuständen verschiedener
Symmetrie erfolgen. Für diese Regel gibt es keine Ausnahme, solange
die Symmetrie erhalten bleibt.
Als Beispiel für eine Korrelation nehmen wir die Kombination der
2px-Atomorbitale der getrennten Atome (ganz rechts in Abb.2).
Wir erhalten die beiden Molekülorbitale 1πu
und 1πg (Bildmitte Abb.2), die für
R → 0 in die beiden Atomorbitale 2px
(aus 1πu) bzw. 3dzx (aus
1πg) des vereinigten Atoms übergehen.Zur
Beschreibung von Dissoziationen im MO-Bild ist jedoch Vorsicht geboten:
wie bereits das Beispiel H2+ gezeigt hat, liefert
die Zuordnung eines Elektrons zu einem MO der getrennten Atome keine
vernünftige Beschreibung der physikalischen Situation; das
Elektron im H2+ kann für R →∞
nicht jeweils zur Hälfte bei den getrennten Kernen sein.
| 2px | 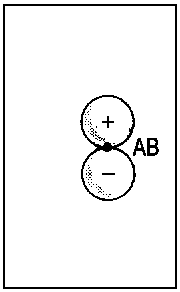 |
Û | 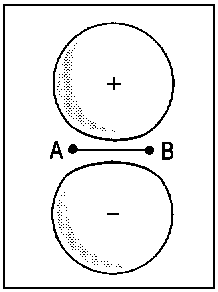 |
Û | 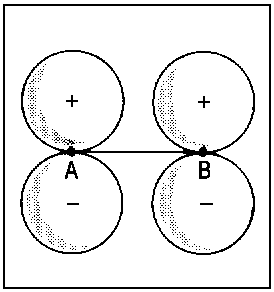 |
2pxA+2pxB |
| 3dzx | 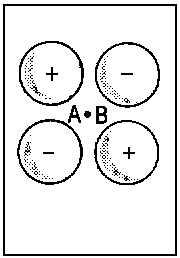
Vereinigtes Atom |
Û | 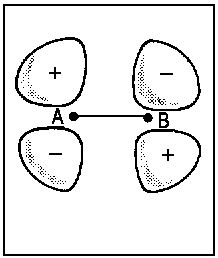
|
Û | 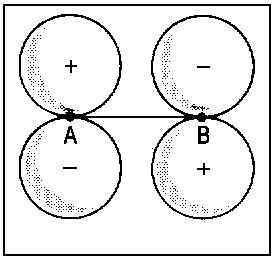
Getrennte Atome |
2pxA−2pxB |
| Abb.2: Beispiele der Korrelation von Orbitalen für die Grenzfälle des vereinigten Atoms und der getrennten Atome (für zweiatomige homonukleare Moleküle). Das obere Diagramm zeigt, wie die πu-Kombination zweier p-Orbitale der getrennten Atome (rechts) mit dem p-Orbital des vereinigten Atoms (links) korreliert. Das untere Diagramm zeigt, wie die πg-Kombination (rechts) mit dem d-Orbital des vereingten Atoms (links) korreliert. Die Atomorbitale des vereinigten Atoms sind relativ kompakt infolge der erhöhten Kernladung beim Zusammenführen von A und B. | ||||||
2σg : c11 (2sA
+ 2sB) + c12 (2pzA−
2pzB)
3σg : c21 (2sA
+ 2sB) + c22 (2pzA−
2pzB)
![]()
Auf diesem Webangebot gilt die Datenschutzerklärung der TU Braunschweig mit Ausnahme der Abschnitte VI, VII und VIII.