 |
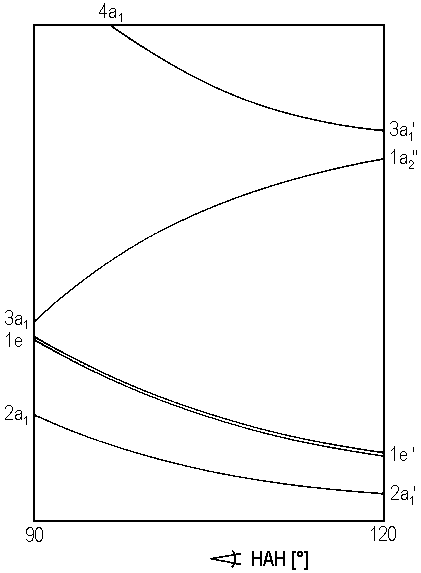
| Abb. 1: Walsh-Diagramm für AH3-Moleküle |
Ähnlich wie für AH2-Moleküle, bei denen ein Walsh-Diagramm die Abhängigkeit der MO-Energien vom HAH-Winkel wiedergibt, kann man für AH3-Moleküle unter der Voraussetzung, dass die C3v-Symmetrie erhalten bleibt, ein Walsh-Diagramm für die Abhängigkeit der MO-Energien von einem der drei äquivalenten HAH-Winkel konstruieren (siehe Abb. 1). Ein Winkel von 120° bedeutet dann eine planare Anordnung und D3h-Symmetrie, ein Winkel kleiner als 120° pyramidale Anordnung und C3v-Symmetrie.
Mit einer analogen Argumentation wie bei den AH2-Molekülen
findet man dann für die Geometrie des Grundzustandes in Abhängigkeit
von der Zahl der Valenzelektronen:
| 1 - 4 Valenzelektronen: | planar |
| 5 - 6 Valenzelektronen: | planar |
| 7 - 9 Valenzelektronen: | pyramidal |
| 10 - 14 Valenzelektronen: | planar |
Für AH3-Moleküle mit 1 - 4 Valenzelektronen sind kaum Beispiele bekannt. Man kennt allenfalls das BeH3+ mit vier Valenzelektronen von quantenchemischen Rechnungen. Dieses ist im Grundzustand offenbar planar, es hat aber nicht D3h-, sondern C2v-Symmetrie, etwa gemäß
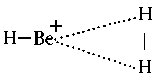
Dieses Molekül ist in erster Näherung als ein loser Komplex zwischen BeH+ und H2 aufzufassen.
Das BH3 ist mit sechs Valenzelektronen ebenso wie das isoelektronische
CH3+ im Grundzustand planar mit D3h-Symmetrie.
Das CH3 mit sieben Valenzelektronen ist ebenfalls planar,
aber das Minimum ist extrem flach. Hingegen sind die Acht-Valenzelektronen-Systeme
CH3−, NH3 und
OH3+ deutlich pyramidal. Neun Valenzelektronen hat
das neuerdings diskutierte OH3, das auch pyramidal sein sollte,
während AH3-Moleküle mit zehn und mehr Valenzelektronen
unbekannt sind.
In einem gewissen Kontrast zur scheinbaren Einfachheit der Walshschen Regeln steht die Tatsache, dass zuverlässige quantenchemische Berechnungen der Gleichgewichtsgeometrien von AH3-Molekülen recht aufwendig sind. Neben der Gleichgewichtsgeometrie interessiert man sich im allgemeinen für die sogenannte Inversionsbarriere EI, das ist der Energieunterschied zwischen der Gleichgewichtsanordnung und der energetisch tiefsten planaren Anordnung. Es gibt nämlich die Möglichkeit eines "Umklappens" der Pyramide die über die ebene Anordnung als Zwischenstufe läuft.
Die Häufigkeit des Umklappens hängt davon ab, wie groß die mittlere thermische Energie verglichen mit der Inversionsbarriere ist, die Umklapphäufigkeit ist folglich temperaturabhängig.
Versucht man, Gleichgewichtsgeometrien und Inversionsbarrieren von AH3-Molekülen zu berechnen, so führen SCF-Rechnungen mit LCAO-Basen zu schlechten Ergebnissen, man muss vielmehr sogenannte Polarisationsfunktionen zum Basissatz hinzufügen, insbesondere d-artige Funktionen am Atom A und p-artige an den H-Atomen. Im Falle des NH3 ergibt z.B. eine Rechnung ohne Polarisationsfunktionen α = 120° (d.h. die ebenen Struktur ist stabiler als die pyramidale), eine SCF-Rechnung mit Polarisationsfunktion α = 107°, EI = 22kJ/mol, während die experimentellen Werte α = 106°7', EI = 24 kJ/mol sind. Ohne Polarisationsfunktionen wird die ebene Anordnung unrealistisch bevorzugt, und man erhält zu kleine Inversionsbarrieren, bzw. die ebene Anordnung kommt stabiler heraus.
Auffällig ist, dass die dem NH3 isoelektrischen Ionen CH3− und OH3+ deutlich verschiedene Gleichgewichtsgeometrien und Inversionsbarrieren haben. Letztere sind sowohl beim CH3− wie beim OH3+ von der Größenordnung 4 kJ/mol. Im Gegensatz dazu liegt die Inversionsbarriere des PH3 bei 150 kJ/mol.
Komplizierter wird die Situation bei AH4-Molekülen, deren Geometrie man schlecht durch einen einzigen Parameter beschreiben kann. AH2-Moleküle haben nur einen winkelartigen Freiheitsgrad, AH3-Moleküle deren drei und AH4-Moleküle sogar fünf. Man hätte also ein Walsh-Diagramm in sechs Dimensionen zu betrachten. Die Konzeption der Walsh-Diagramme ist hier jedoch etwas überfordert.
![]()
Auf diesem Webangebot gilt die Datenschutzerklärung der TU Braunschweig mit Ausnahme der Abschnitte VI, VII und VIII.