Wir wollen an dieser Stelle herausfinden, wie gross die Geschwindigkeit von Atomen und Molekülen ist, wenn wir diese Teilchen gemäss der kinetischen Gastheorie behandeln, d.h. wir idealisieren die Spezies zu Punkten, die keine spezifischen inneren Freiheitsgrade besitzen. Wir folgen dabei Clerk Maxwell, um die Verteilung der Komponenten der Teilchengeschwindigkeiten in einem perfekten Gas herleiten zu können. Die wesentliche Voraussetzung ist dabei, dass die drei Komonenten vx, vy und vz voneinander unabhängig sind. Deshalb ist die Wahrscheinlichkeit, dass ein Teilchen eine Geschwindigkeit mit Komponenten zwischen vx und vx + dvx und vy und vy + dvy und vz und vz + dvz hat, gleich dem Produkt der einzelnen Wahrscheinlichkeiten:
F(v) dv = f(vx) f(vy) f(vz) dvx dvy dvz
Wir bringen jetzt ein, dass die Geschwindigkeitsverteilung F(v) raumsymmetrisch sein soll, dass also F(v) nur von der Geschwindigkeit v und nicht von den einzelnen Komponenten vx,vy und vz abhängen soll. Beispielsweise soll eine Geschwindigkeit mit den Komponenten vx = 0,2 km/s; vy = 0,3 km/s und vz = 0,6 km/s, also dem Betrag v = (0,22 + 0,32 + 0,62)1/2 = 0,7 km/s, gleich wahrscheinlich sein, wie eine Geschwindigkeit mit dem Komponenten vx = 0,6, vy = 0,2 und vz = 0.3 km/s oder irgend eine andere mit v = 0,7 km/s. Weil F demnach nur von v2 = vx2 + vy2 + vz2 abhängen soll, schreiben wir einfach
F(vx2 + vy2 + vz2) = f(vx)f(vy)f(vz).
Diese Gleichung kann nur von einer Exponentialfunktion erfüllt werden, denn es ist ex+y+z = exeyez. Wir können also direkt schreiben
f(vx) = ae±bvx²
wobei die Konstanten a und b noch zu bestimmen sind. Die Lösung erfüllt unsere Bedingung
f(vx)f(vy)f(vz) = a3e±b(vx² + vy² + vz²) = F(vx2 + vy2 + vz2).
Die Zweideutigkeit des Vorzeichens ist schnell beseitigt: Die Wahrscheinlichkeit darf nicht ins Unendliche wachsen, es kommt also nur das negative Vorzeichen in Frage. Die Konstanten a und b lassen sich wie folgt berechnen. Da jedes Teilchen irgendeine Geschwindigkeit zwischen -∞ und +∞ haben muss, muss gelten:
-∞∫∞f(vx)dvx = 1.
Wir erhalten:
-∞∫∞f(vx)dvx = a -∞∫∞e-bvx²dvx = a(π/b)½ = 1.
Es ist also a = (b/π)½ und damit
f(vx) = (b/π)½e-bvx²
Die Größe b bestimmen wir über den bereits bekannten Mittelwert von vx2 :
<vx2> = -∞∫∞vx2f(vx)dvx = (b/π)½ -∞∫∞vx2e-bvx²dvx.
Das Integral ergibt 1/2(π/b3)½
und daher
Wir kennen bereits <vx2>, denn es gilt ja
1/2m<v2> = 1/2m(<vx2>+<vy2>+<vz2>) = Etrans.
Da im Mittel die Beiträge bzgl. x,y,z gleich sein müssen, gilt
1/2m<vx2> = 1/3 Etrans = 1/2kT,
d.h. <vx2> = kT/m. Man nennt dies das Gleichverteilungsgesetz.
Jetzt haben wir die Größe b:
und die vollständige Formel für die Verteilung der Geschwindigkeitskomponenten
lautet:
|
|
Man nennt diese Gleichung die Maxwell-Boltzmann-Verteilung
der Molekülgeschwindigkeiten (Hier etwas über Clerk
Maxwell und Ludwig
Boltzmann).
Mit Hilfe der hochauflösenden Spektroskopie kann diese Geschwindigkeitsverteilung
über den Doppler-Effekt indirekt nachgewiesen werden.
Die Verteilung der Teilchengeschwindigkeiten ohne Berücksichtigung
ihrer Richtung erhält man in der folgenden Weise. Die Wahrscheinlichkeit,
dass ein Teilchen Geschwindigkeitskomponenten zwischen vx
und vx + dvx und vy und vy
+ dvy und vz und vz + dvz hat,
ist gegeben durch:
F(v)dv = f(vx)f(vy)f(vz)dvxdvydvz = (m/2πkT)3/2 e-mv²/2kT dvxdvydvz.
Die Wahrscheinlichkeit F(v)dv, dass ein Teilchen eine Geschwindigkeit
zwischen v und v + dv hat, ist gleich der Summe der Wahrscheinlichkeiten,
dass es in irgendeinem der Volumenelemente dvxdvydvz
liegt, die zusammen eine Kugelschale mit dem Radius v bilden. Die Summe
der Volumenelemente auf der rechten Seite der Gleichung entspricht dem
Volumen dieser Kugelschale (4πv2dv).
So ergibt sich
|
|
Das ist die sogenannte Maxwell-Verteilung der Molekülgeschwindigkeiten
(Originalveröffentlichung).
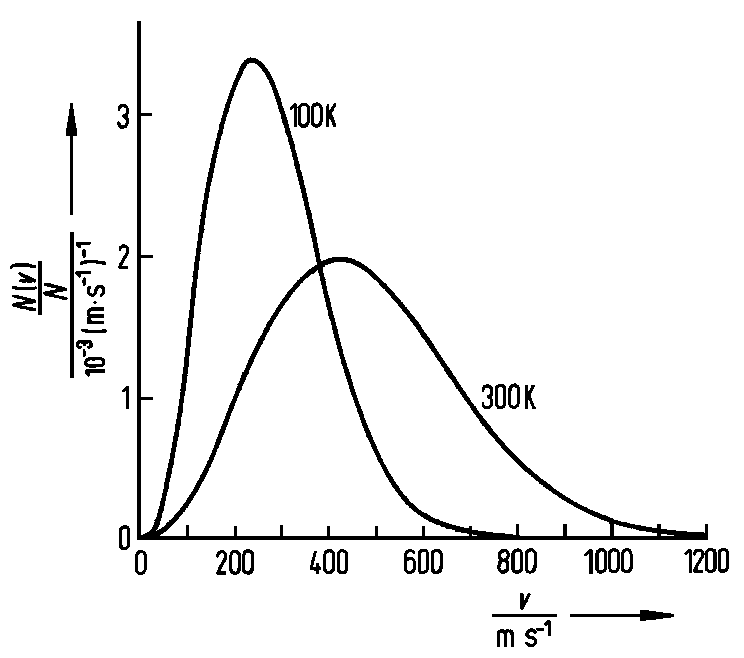 |
| Geschwindigkeitsverteilung für Stickstoff bei verschiedenen Temperaturen |
Eigenschaften
der Maxwell-Verteilung:
Die Maxwellsche Geschwindigkeitsverteilung ist in der Abb. für
N2 bei T = 100 K und T = 300 K dargestellt.
Man erkennt, dass die Verteilung bei höheren Temperaturen breiter
wird und dass die wahrscheinlichste Geschwindigkeit vm
(definiert durch das Maximum der Verteilungskurve) bei höheren Temperaturen
zu größeren Werten verschoben ist. vm erhalten wir
aus der Extremwertbestimmung von F(v):
dF(v)/dv½v=vm = 0 →
|
|
Sie unterscheidet sich ein wenig von der quadratisch gemittelten Geschwindigkeit
|
|
Die mittlere Geschwindigkeit <v>
erhalten
wir durch Auswerten des Integrals <v>
= o∫∞vF(v)dv:
|
|
Bei leichteren Teilchen sind die mittleren Geschwindigkeiten größer
als bei schweren Teilchen; die Tabelle enthält einige Zahlenwerte:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
![]()
Auf diesem Webangebot gilt die Datenschutzerklärung der TU Braunschweig mit Ausnahme der Abschnitte VI, VII und VIII.