Es gibt Reaktionen, die - absichtlich oder unabsichtlich - explosionartig verlaufen. Dabei sind zwei Arten von Explosionen zu unterscheiden: Thermische Explosionen kommen durch den raschen Anstieg der Reaktionsgeschwindigkeit bei höheren Temperaturen zustande. Wenn bei einer exothermen Reaktion Energie nicht abfließen kann, steigt die Temperatur des Systems und bewirkt eine Zunahme der Reaktionsgeschwindigkeit. Das kann wiederum die Temperaturerhöhung beschleunigen usw. bis zur Explosion. Von einer Kettenverzweigungs-Reaktion sprechen wir, wenn im Verlaufe einer Reaktion die Anzahl der Radikale durch Verzweigungsreaktionen zunimmt, so dass die Reaktionsgeschwindigkeit steigt und die Reaktion sich zur Explosion entwickelt.
Beide Typen findet man bei der Knallgas-Reaktion:
2H2 + O2 → 2 H2O
Der Mechanismus dieser Reaktion ist wesentlich komplizierter, als die
einfache Reaktionsgleichung vermuten läßt, und nur die wesentlichen
Einzelschritte sollen erläutert werden. Es handelt sich um eine Kettenreaktion,
bei der die Radikale H, O, OH und HO2 als Kettenüberträger
auftreten. Die wichtigsten Schritte sind:
| Kettenstart (Zündung): | H2 + O2 → 2 HO + Wand | (langsame Radikalbildung) |
| Ketten-Fortpflanzung: | H2 + HO → H + H2O | (Radikalzahl konstant) |
| Verzweigung: | H + O2 → HO + O | (Radikalverdopplung) |
| Verzweigung: | O + H2 → HO + H | (Radikalverdopplung) |
| Ketten-Abruch: | H + Wand → P | (Radikalvernichtung) |
Die Schritte 3 und 4 sind für die Verzweigungen (Bildung zweier
Radikale aus einem) verantwortlich, die zur Explosion führen können,
wenn die Geschwindigkeit für die Verzweigung größer ist
als für die Abbruchreaktionen. Ob eine Explosion erfolgt, hängt
von der Temperatur (H + O2 ist stark tempetaturabhängig)
und vom Druck des Systems ab; die Bereiche, in denen die Knallgas-Reaktion
explosiv ablaufen kann, sind in der Abbildung schraffiert dargestellt.
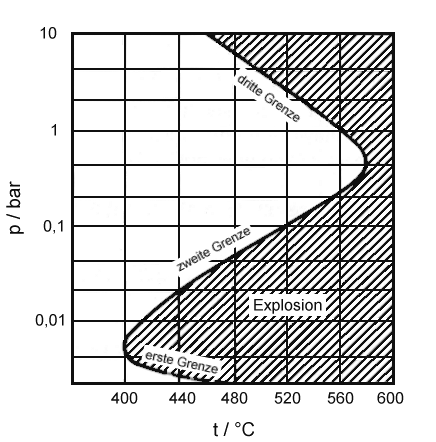 |
| Abb. 1: Die Explosionsgrenzen bei der Knallgas-Reaktion |
Bei sehr kleinen Drücken läuft die Reaktion langsam ohne Explosion
ab, weil die bei der Kettenverzweigung entstehenden Kettenträger eher
die Gefäßwand als andere Moleküle erreichen und dort (in
Abhängigkeit von deren Zusammensetzung) zu inaktiven Molekülen
rekombinieren. Erhöht man den Druck etwa längs der 440°C-Linie,
so erreicht das System die erste Explosionsgrenze. Dann explodiert die
Mischung, weil die aktiven Radikale mit anderen Molekülen reagieren,
ehe sie die Gefäßwände erreichen, so dass die Verzweigungsreaktionen
effizient werden. Wenn der Druck oberhalb der zweiten Explosionsgrenze
liegt, verläuft die Reaktion wieder still, weil die Radikale, die
bei den Verzweigungsreaktionen entstehen, wieder miteinander rekombinieren.
Jetzt treten Reaktionen wie H + O2 →
HO2 auf, und die dabei freiwerdende Energie wird bei einem Dreierstoß
auf ein anderes unbeteiligtes Molekül M übertragen:
| Kettenabbruch: | H + O2 + M → HO2 + M* | (HO2 reagiert nur langsam) |
Dreierstöße sind bei kleine Drücken relativ selten;
erst bei hohen Drücken gewinnen sie an Bedeutung und inhibieren die
Kettenfortpflanzung, weil das entstehende HO2 nicht direkt an
der Verzweigungsreaktion teilnimmt. Wenn man den Druck weiter erhöht,
dann wird das HO2 in OH überführt (dritte Explosionsgrenze):
| Ketten-Fortpflanzung: | HO2 + H2 → H2O + OH |
d.h. die Abbruchreaktion wird neutralisiert.
![]()
Auf diesem Webangebot gilt die Datenschutzerklärung der TU Braunschweig mit Ausnahme der Abschnitte VI, VII und VIII.