Was wäre ein Fußballspiel im Fernsehen ohne die Zeitlupe,
die im Nachhinein die Bewegungen der Spieler und des Balls nachvollzieht,
wenn ein Tor gefallen ist. Dasselbe gilt für chemische Reaktionen.
Die Neugier der Chemiker darauf, chemischen Reaktionen bis in kleinste
Einzelheiten folgen zu können, hat immer ausgeklügeltere Methoden
hervorgebracht. Der Nobelpreisträger des Jahres 1999, Ahmed
H. Zewail, hat Atome und Moleküle mit Hilfe einer "Zeitlupe"
während einer Reaktion untersucht und gesehen, was eigentlich geschieht,
wenn chemische Verbindungen zerbrechen und neue entstehen.
Eine hervorragende Übersicht mit ausgewählten Beispielen
und sehr illustrativen Bildern ist in diesem pdf-Artikel
von Zewail zu finden (5,6Mb).
Zewail hat sich einer Technik bedient, die man als die schnellste Kamera der Welt beschreiben kann. Sie läuft darauf hinaus, dass man so kurze Laserblitze benutzt, dass man den Zeitraum erreicht, in dem die Reaktionen tatsächlich stattfinden, nämlich Femtosekunden (fs). Eine Femtosekunde entspricht 10-15 Sekunden, d.h. 0,000000000000001 Sekunden; im Verhältnis zu einer Sekunde ist dies genauso wenig wie eine Sekunde im Verhältnis zu 32 Millionen Jahren. Dieses Gebiet im Bereich der physikalischen Chemie hat den Namen Femtochemie erhalten.
Mit Hilfe der Femtochemie kann man verstehen, warum bestimmte chemische
Reaktionen stattfinden, andere aber nicht. Man kann auch erklären,
warum die Geschwindigkeit der Reaktionen und ihr Wirkungsgrad von der Temperatur
abhängig sind. Rundum auf der Welt untersuchen Wissenschaftler mit
Hilfe der Femtosekundenspektroskopie diesen Prozeß in Gasen, Flüssigkeiten
und in festen Materialien, auf Oberflächen und in Polymeren. Die Anwendungsbereiche
umspannen die Funktion von Katalysatoren und die Konstruktion molekularer
elektronischer Komponenten bis hin zu den feinsten Mechanismen der Lebensprozesse
und in Zukunft der Herstellung von Arzneimitteln.
Wie schnell verlaufen chemische Reaktionen?
Wie wir alle wissen, können chemische Reaktionen mit sehr unterschiedlichen
Geschwindigkeiten ablaufen - man braucht nur rostende Nägel mit explodierendem
Dynamit zu vergleichen! Gemeinsam für die meisten Reaktionen ist jedoch,
dass sich ihre Geschwindigkeit vergrößert, wenn sich die
Temperatur erhöht, d.h. wenn die Bewegung der Moleküle heftiger
wird.
Daher haben die Wissenschaftler seit langem geglaubt, dass ein Molekül zuerst "aktiviert", sozusagen mit einem Tritt über eine Grenze befördert werden muss, um zu reagieren. Wenn zwei Moleküle zusammenstoßen, so geschieht gewöhnlich nichts, sie prallen lediglich aneinander ab. Aber wenn die Temperatur hoch genug ist, dann ist der Zusammenprall so heftig, dass sie miteinander reagieren und sich neue Moleküle bilden. Wenn ein Molekül so einen kräftigen "Temperaturtritt" bekommen hat, reagiert es unerhört schnell, wobei sich chemische Verbindungen auflösen und neue entstehen. Dies gilt auch für Reaktionen, die langsam verlaufen, so zum Beispiel bei einem Nagel, der rostet. Der Unterschied besteht nur darin, dass die "Temperaturtritte" in einer langsamen Reaktion seltener eintreffen als in einer schnellen.
Die Grenze wird von den Kräften bestimmt, die die Atome im Molekül,
d.h. den chemischen Verbindungen, zusammenhalten; man kann sie in etwa
mit der Gravitationsgrenze vergleichen, die eine Mondrakete von der Erde
überwinden muss, ehe sie vom Kraftfeld des Mondes eingefangen
wird. Aber über den Weg eines Moleküls über diese Grenze
und über sein eigentliches Aussehen, wenn es gerade den höchsten
Punkt, den sogenannten "Übergangszustand", erreicht hat, wußte
man bis in die jüngste Gegenwart nicht viel.
Hundert Jahre Forschung
Svante Arrhenius, der Chemie-Nobelpreisträger des Jahres 1903,
der seinerseits von van't Hoff, dem ersten Chemie-Nobelpreisträger
aus dem Jahr 1901, angeregt worden war, beschrieb vor mehr als hundert
Jahren eine einfache Formel für die Reaktionsgeschwindigkeit als Funktion
der Temperatur. Aber sie galt für viele Moleküle auf einmal,
d.h. für makroskopische Systeme, und über verhältnismäßig
lange Zeiträume. Erst in der 30er Jahren formulierten H. Eyring und
M. Polanyi eine Theorie, die auf Reaktionen in mikroskopischen Systemen
mit einzelnen Molekülen baute. In dieser Theorie nahm man an, dass
der Übergangszustand in dem Zeitraum, der für molekulare Schwingungen
gilt, sehr schnell überwunden würde. Daß man jemals Experimente
in so kurzen Zeitabständen machen könnte, davon konnte man damals
nicht einmal träumen.
Aber Zewail widmete sich gerade dieser Frage zielbewußt. Gegen Ende der 80er Jahre führte er eine Serie von Experimenten durch, die die Geburt des Forschungsgebiets bedeutete, das Femtochemie genannt wird. Im Prinzip läuft es dabei darauf hinaus, mit einer Hochgeschwindigkeitskamera Moleküle während des Ablaufs chemischer Reaktionen abzubilden und ein Bild von ihnen genau dann einzufangen, wenn sie sich im Übergangszustand befinden. Die Kamera baute auf neuentwickelte Lasertechnik mit Lichtblitzen von einigen -zig Femtosekunden auf. Die Zeit, die Atome benötigen, um in einem Molekül eine Schwingung auszuführen, beträgt im Normalfall 10-100 fs. Daß chemische Reaktionen im gleichen Zeitraum ablaufen sollten in dem Atome in den Molekülen hinundherschaukeln, kann man mit zwei Trapezkünstlern vergleichen, die aufeinander in demselben Zeitraum "reagieren", in dem ihre Trapeze hinundherpendeln.
Was sah man nun, wenn man die Zeitauflösung nach und nach verbesserte? Die ersten Erfolge bestanden aus Entdeckungen von Stoffen, sogenannten Intermediären, die sich auf dem Weg zwischen den ursprünglichen Stoffen und den Schlußprodukten bildeten. Anfänglich handelte es sich um vergleichsweise stabile Moleküle oder Molekülfragmente. Jede Verbesserung der Zeitauflösung führte dazu, dass man neue Glieder einer Reaktionskette, in Gestalt immer kurzlebigerer Intermediärer in das Puzzle einfügen konnte, um dadurch denn Reaktionsmechanismus zu verstehen.
Die Leistung, für die Zewail der Nobelpreis verliehen wird, bedeutet,
dass wir das Ende des Weges erreicht haben: schneller als gehabt können
keine chemischen Reaktionen stattfinden. Mit der Femtosekundenspektroskopie
können wir zum ersten Mal in Zeitlupe beobachten, was bei dem Übergang
über die Reaktionsgrenze geschieht, und damit auch den mechanistischen
Hintergrund verstehen, sowohl der Formel für die Temperaturabhängigkeit
von Arrhenius als auch der Formeln, für die van't Hoff den Nobelpreis
erhielt.
Die Femtochemie in der Praxis
Bei der Femtosekundenspektroskopie mischt man die ursprünglichen
Stoffe in Form von Molekularstrahlen in einer Vakuumkammer. Danach läßt
man einen ultraschnellen Laser zwei Pulse hineinschießen: zuerst
einen starken Pump-puls, der das Molekül trifft und es in einen
höheren Energiezustand versetzt, und danach einen schwächeren
Proben-puls
mit einer Wellenlänge, die darauf eingestellt ist, das Molekül
in seiner ursprünglichen Form oder in einer veränderten Form
zu entdecken. Der Pump-puls gibt den Startschuß für die Reaktion,
während der Prob-puls untersucht, was geschieht. Indem man das Zeitintervall
zwischen Pump- und Prob-puls verändert, kann man sehen, wie schnell
sich das ursprüngliche Molekül verwandelt. Die neuen Erscheinungsformen,
die das Molekül annimmt, wenn sich sein Energieniveau erhöht
- und vielleicht den ein oder anderen Übergangszustand überschreitet
- haben Spektren, die man wie Fingerabdrücke benutzen kann. Das Zeitintervall
zwischen den Pump- und Prob-pulsen kann man auf einfache Art dadurch verändern,
dass man den Prob-puls mit Hilfe von Spiegeln einen Umweg nehmen läßt.
Aber es handelt sich nicht um lange Umwege: das Licht legt die Strecke
von 0,03 mm in 100 fs zurück.
Um besser zu verstehen, was passiert, vergleicht man zum Abschluß
die Fingerabdrücke und den zeitlichen Ablauf mit theoretischen Simulationen,
die auf den Resultaten quantenmechanischer Berechnungen (der Nobelpreis
von 1998) der Spektra und Energien für die Moleküle in ihren
verschiedenen Zuständen gründen.
Die ersten Versuche
In seinem ersten Versuch untersuchte Zewail den Zerfall von Jodcyanid:
ICN --> I + CN. Der Forschungsgruppe gelang es, den
Übergangszustand genau in dem Augenblick zu beobachten, als die I-C-Verbindung
im Begriffe war zu zerbrechen; die Reaktion lief in insgesamt 200 Femtosekunden
ab.
In einem anderen wichtigen Experiment untersuchte Zewail die Spaltung von Natriumjodid (NaI): NaI --> Na + I. Der Pump-puls erhöht das Energieniveau des Ionenpaars Na+I -, bei dem der Gleichgewichtsabstand 2.8 Å zwischen den Atomkernen besteht (Abb. 1), zu einer aktivierten Form [NaI]*, die dann eine kovalente Bindung erhält. Indessen veränderten sich die Eigenschaften, wenn das Molekül schwingt; liegen die Atomkerne in ihren äußersten Wendepunkten 10-15 Å auseinander, so ist die Elektronenstruktur ionisch, während sie also bei kurzem Abstand kovalent ist. An einem bestimmten Punkt während des Schwingungszyklus, wenn die Atomkerne gerade 6,9 Å voneinander entfernt sind, ist die Wahrscheinlichkeit groß, dass die Moleküle entweder in ihren Grundzustand zurückfallen oder in Natrium- und Jod-Atome zerfallen.
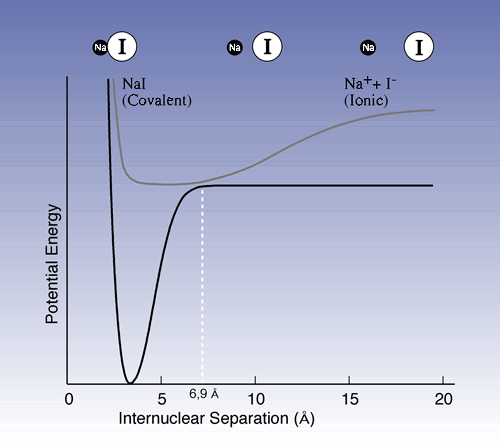
Abb. 1
Potentialenergiekurven, die den ursprünglichen
Zustand sowie den Zustand mit einem erhöhten Energieniveau für
NaI zeigen. Die obere Kurve zeigt die Molekülschwingungen des NaI
bei erhöhtem Energieniveau. Wenn der Abstand zwischen dem Natrium-Kern
und dem Jod-Kern kurz ist, dominiert die kovalente Bindung, während
die Ionen-Bindung bei längerer Entfernung vorherrscht. Die Schwingungen
können mit einer Kugel verglichen werden, die in einer Schale hinundherrollt.
Wenn der Punkt 6,9 Å überschritten wird, besteht die Chance,
dass die Kugel zur unteren Kurve hinunterfällt. Dort kann sie
in der Grube links (zurück zum Grundzustand) landen oder nach rechts
hinausfliegen, d.h. in Natrium- und. Jodatome zerfallen.
Zewail untersuchte auch die Reaktion zwischen Wasserstoff und Kohlendioxid: H + CO2 ® CO + OH eine Reaktion, die in der Atmosphäre und bei Verbrennung geschieht. Er wies nach, dass die Reaktion über einen relativ langlebigen Zustand HOCO (1000 fs) abläuft.
Die Frage, warum bestimmte chemische Verbindungen reaktionsfreudiger sind als andere und was geschieht, wenn man zwei gleichartige Verbindungen in einem Molekül hat - werden sie gleichzeitig zerbrechen oder jeweils eine nach der anderen -, hat viele Chemiker beschäftigt. Um eine Antwort auf diese Art von Fragen zu erhalten, untersuchten Zewail und seine Mitarbeiter den Zerfall der Moleküle Tetrafluordijodmethan (C2I2F4), in Tetrafluoräthylen (C2F4) und zwei Jodatome (I):
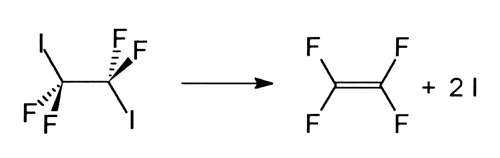
Sie entdeckten, dass die beiden C-I-Verbindungen jeweils eine
nach der anderen zerbrochen wurden, obwohl sie im ursprünglichen Molekül
gleichwertig waren.
Forschung ist vor allem dann interessant, wenn die Resultate unerwartet
sind. Zewail untersuchte die, wie man meinen kann, einfache Reaktion zwischen
Benzol, einem Ring mit sechs Kohlenatomen (C6H6),
und Jod (I2), einem Molekül, das aus
zwei Jodatomen besteht. Wenn die beiden Moleküle einander nahe genug
kommen, bilden sie einen Komplex. Durch den Laserblitz wird erreicht, dass
ein Elektron vom Benzol in das JodMolekül geschossen wird, das dadurch
negativ, das Benzol dagegen positiv geladen wird. Die negativen und positiven
Ladungen haben zur Folge, dass Benzol und das nächste Jodatom
sich gegenseitig schnell anziehen. Die Bindung zwischen den beiden Jodatomen
dehnt sich aus, wenn eins der beiden vom Benzol angezogen wird; das eine
Atom löst sich dann und fliegt weg. All das geschieht binnen 750 fs.
Zewail entdeckte indessen, dass das nicht die einzige Art und Weise
ist, wie einzelne Jodatome gebildet werden können: manchmal fällt
das Elektron auf das Benzol zurück. Aber in dem Augenblick ist es
für die Jodatome bereits zu spät: wie ein ausgedehntes Gummiband,
das zerreißt, zerbricht die Bindung zwischen den beiden Atomen, und
sie fliegen beide in verschiedene Richtung.
Forschungsexplosion
Eine häufig untersuchte Modellreaktion im Bereich der organischen
Chemie ist die Ringöffnung des Cyclobutans, um Äthylen zu erhalten,
oder die Umkehrung: zwei Äthylenmoleküle, die sich zu Cyclobutan
vereinigen. Man kann sich denken, dass die Reaktion direkt über
einen Übergangszustand mit einer einfachen Aktivierungsgrenze abläuft,
wie es das Schema zur Linken in Abbildung 2 zeigt. Alternativ könnte
dies auch durch ein Zweischrittsystem in der Weise geschehen, wie das Schema
zur Rechten zeigt, indem zuerst eine Bindung zerbrochen und Tetrametylen
als Zwischenprodukt gebildet wird. Tetrametylen wird seinerseits nach der
Überwindung einer weiteren Aktivierungsgrenze in das endgültige
Produkt verwandelt. Zewail und seine Mitarbeiter konnten mit Hilfe der
Femtosekundenspektroskopie nachweisen, dass sich das Zwischenprodukt
in der Tat bildete und dass es eine Lebenslänge von 700 fs hatte.
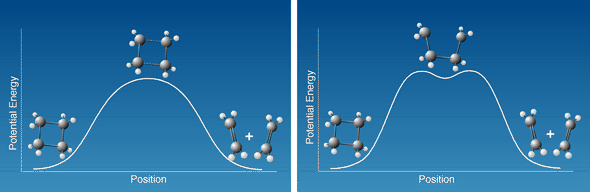
Abb. 2
Wie verläuft eigentlich die Reaktion vom Molekül
Cyclobutan zu zwei ÄthylenMolekülen? Die Figur links zeigt, wie
die Lagenenergie variiert, wenn die beiden Bindungen gestreckt werden und
zerbrechen. Die Figur rechts zeigt den gleichen Prozeß, wenn eine
Bindung nach der anderen zerbrochen wird.
Eine andere Art der Reaktion, die mit Hilfe der Femtosekundentechnik untersucht werden kann, ist die durch Licht verursachte Umwandlung eines Moleküls von einer Struktur zu einer anderen, die sogenante Fotoisomerisierung. Die Umwandlung des Moleküls Stilben, das u.a. aus zwei Benzolringen besteht, zwischen den Formen Cis und Trans wurde von Zewail und seinen Mitarbeitern beobachtet.
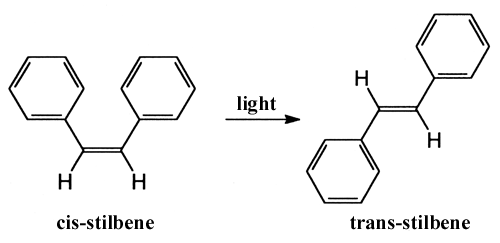
Sie zogen die Schlußfolgerung, dass sich die beiden Benzolringe während des Prozesses zueinander synchron drehen. In jüngster Zeit hat man ein ähnliches Verhalten auch bei dem Molekül Retinal beobachtet, dem Farbstoff in Rodopsin, dem Pigment in den Augenstäbchen. Der grundlegende fotochemische Schritt für unsere Wahrnehmung des Lichts ist die Cis-Trans-Verwandlung um eine Doppelbindung in Retinal. Mit Hilfe der Femtosekundenspektroskopie haben andere Forscher entdeckt, dass der Prozeß in 200 fs abläuft und dass eine gewisse Schwingung beim Reaktionsprozeß bestehenbleibt. Die Geschwindigkeit der Reaktion deutet darauf hin, dass die Energie des absorbierten Photons zuerst nicht umverteilt wird, sondern direkt zur aktuellen Doppelbindung lokalisiert wird. Dies würde den hohen Wirkungsgrad (70%) der Umwandlung und damit die gute Nachtsehfähigkeit des Auges erklären. Ein weiteres, biologisch wichtiges Beispiel für die Erklärung effektiver Energieumwandlung durch die Femtochemie gilt für die Chlorophyllmoleküle, die in der Fotosynthese das Licht einfangen.
Studien im Femtosekundenbereich werden rundum in der Welt betrieben, nicht nur an Molekülstrahlen, sondern auch an Prozessen auf Oberflächen, so zum Beispiel um Katalysatoren zu verstehen und zu verbessern, in Flüssigkeiten und Lösungsmitteln, um hier die Mechanismen der Lösung von Stoffen und chemische Reaktionen zwischen ihnen in einer Lösung zu verstehen, sowie bei Polymeren, um zum Beispiel neues Elektronikmaterial zu entwickeln. Kenntnisse der chemischen Reaktionsmechanismen sind ebenfalls wichtig, um Reaktionen zu steuern. Oft folgt auf eine gewünschte chemische Reaktion eine Reihe unvorhergesehener, konkurrierender Reaktionen, die zu einer Mischung von Produkten führt und damit zu einem Bedarf an Trennung und Reinigung. Wenn man dagegen die Reaktion dadurch kontrollieren kann, dass man Reaktivität in ausgewählten Verbindungen in Gang bringen kann, könnte man auch dies vermeiden.
Die Femtochemie hat unsere Sicht auf chemische Reaktionen grundlegend
verändert. Mit Ausgangspunkt in einem Prozeß, der mit relativ
dunklen Metaphoren wie "Aktivierung" und "Übergangszustand" beschrieben
wurde, können wir heute die Bewegungen der individuellen Atome so
sehen, wie wir sie uns vorstellen. Sie sind nicht länger unsichtbar.
Das ist der Grund dafür, dass die Forschung im Bereich der Femtochemie,
für die der diesjährige Preisträger den Anstoß gab,
eine explosive Entwicklung genommen hat. Mit der schnellsten Kamera der
Welt in Händen setzt nur die Phantasie Grenzen für neue Probleme,
die es anzugreifen gilt.
Auf diesem Webangebot gilt die Datenschutzerklärung der TU Braunschweig mit Ausnahme der Abschnitte VI, VII und VIII.