Bei großen molaren Volumina und hohen Temperaturen unterscheiden sich reale und ideale Gase nur unwesentlich. Man kann daher das ideale Gasgesetz als das erste Glied der Entwicklung
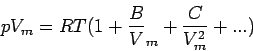
|
ansehen. Diese Zustandsgleichung für reale Gase wird Virialgleichung (von lateinisch vires, Kräfte) genannt. Die temperaturabhängigen Koeffizienten B(T), C(T), ... nennt man den zweiten, dritten, ... Virialkoeffizienten; der erste Virialkoeffizient ist 1. Da bei typischen Temperaturen C(T)/Vm2 << B(T)/Vm ist, hat der dritte Koeffizient C im allgemeinen geringere Bedeutung als B. Die Virialgleichung ist ein Beispiel einer allgemeinen Methode in der Physikalischen Chemie: Die Potenzreihenentwicklung eines einfachen Gesetzes (hier pV = nRT) nach einer Variablen (hier Vm).
Anhand der Virialgleichung können wir folgende wichtige Tatsachen zeigen: Obwohl ein reales Gas für p → 0 die Zustandsgleichung eines idealen Gases erfüllen kann, heißt das nicht, dass dann auch alle seine Eigenschaften mit denen eines idealen Gases übereinstimmen müssen. Betrachten wir beispielsweise den Kompressionsfaktor Z. Für ein ideales Gas gilt, nachdem er für beliebige Drücke den Wert 1 hat, dZ/dp = 0. Allgemein ist aus der Virialgleichung und unter Vernachlässigung des zweiten höherer Virialkoeffizienten folgende Druckabhängigkeit der Größe dZ/dp ableitbar.
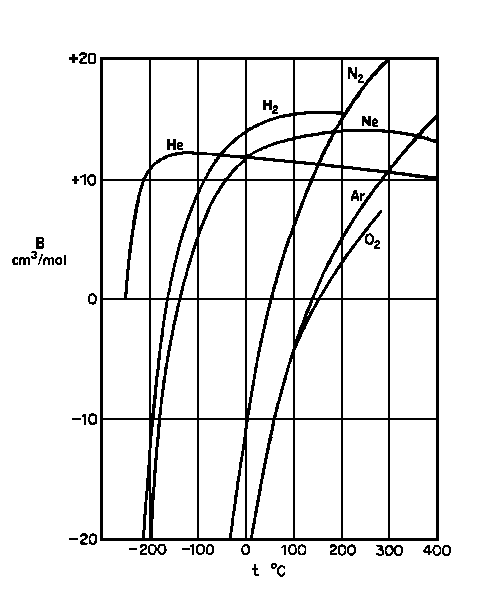 |
| Abb. 1: Der zweite Virialkoeffizient B für verschiedene Gase als Funktion der Temperatur |
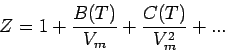 |
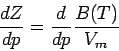 |
Die Ableitung dZ/dp wird nicht notwendigerweise null, weil B von null verschieden sein kann und es ja auch nicht zu erwarten ist, dass reale Gase durchgehend mit dem Modell des idealen Gases beschreibbar sind. Wie wir sehen werden, hängen mehrere physikalische Eigenschaften von derartigen Ableitungen ab.
Da die Virialkoeffizienten
jedoch von der Temperatur abhängen, wie in nebenstehendem
Diagramm dargestellt, können Temperaturen gefunden werden, für die B ebenso wie dZ/dp den Wert Null annehmen.
Bei dieser Temperatur, der Boyle-Temperatur TB, stimmen die Eigenschaften des realen Gases mit idealem Verhalten für p → 0 überein. Für Luft ist
TB = 346,8 K, für Argon ist TB = 411,5 K.
![]()
Auf diesem Webangebot gilt die Datenschutzerklärung der TU Braunschweig mit Ausnahme der Abschnitte VI, VII und VIII.