und chemisches Potential
Wir wollen mit der einfachsten Gleichgewichtsreaktion A ↔ B beginnen . Eine solche Reaktion ist nicht so trivial, wie es scheint, denn Beispiele dafür sind die Isomerisierung von n-Pentan zu iso-Pentan oder die Umwandlung von L-Alanin zu D-Alanin.
Nehmen wir an, eine infinitesimale Menge dξ der Substanz A gehe in B über; dann können wir schreiben:
Änderung der Menge an A = -
dξ ,
Änderung der Menge an B = +
dξ .
ξ ist die sogenannte Reaktionslaufzahl; sie ist ein Maß für den Ablauf einer Reaktion. Sie wird so definiert, dass (für die Reaktion A ↔ B) der Wert ξ = 0 reinem A entspricht und der Wert ξ = 1 angibt, dass 1 mol A verschwunden und 1 mol B entstanden ist.
Wir wollen nun die damit verbundene Änderung der Freien Enthalpie G des Systems berechnen, denn das Minimum von G ist gerade das Gleichgewicht der chemischen Reaktion. Wir erinnern uns: Unser allgemeines Kriterium (dG)T,p ≤ 0 bedeutet für die Chemie, dass: bei konstantem Druck und konstanter Temperatur Reaktionen freiwillig ablaufen, wenn dabei die Freie Enthalpie abnimmt: ΔG = GProdukte −GEdukte. Wenn ΔG negativ ist, dann hat die Reaktion das Bestreben, in der angegebenen Richtung (A → B) abzulaufen. Wenn ΔG positiv ist, so läuft sie spontan nur in der umgekehrten Richtung (A ← B) ab. Um ΔG zu bestimmen, müssen wir die Abhängigkeit der Freien Enthalpie von der Zusammensetzung, d.h. der beteiligten Substanzmengen berücksichtigen (die Abhängigkeit von Druck und Temperatur kennen wir bereits). Ganz allgemein gilt für eine Veränderung der Funktion G(p,T,n1,n2, ...):
dG = (∂G/∂p)T,n1,n2..dp + (∂G/∂T)p,n1,n2..dT + (∂G/∂n1)p,T,n1,n2..dn1 + (∂G/∂n2)p,T,n1,n2..dn2 + ...
So übel diese Gleichung auch aussieht, sie besagt lediglich, dass sich G ändert, wenn sich die Variablen (p, T, n1, n2,...) ändern, wobei n1, n2,... die Molzahlen der beteiligten Substanzen sind. Wir kennen bereits die beiden ersten partiellen Ableitungen:
(∂G/∂p)T,n1,n2...
= V
(∂G/∂T)p,n1,n2...
= - S
Die anderen partiellen Ableitungen geben an, wie sich G ändert,
wenn ein Teilchen einer Substanz (z.B.1) hinzu kommt oder verschwindet.
Wir können einer solchen Ableitung entnehmen, welche Wirkung die betreffende
Substanz (1) auf die gesamte Freie Enthalpie eines Systems mit beliebiger
Zusammensetzung hat. Man nennt eine solche partielle Ableitung
|
|
Der Name wurde analog zur Mechanik gewählt, wo sich Körper
zum Minimum eines Potential bewegen. Thermodynamische Systeme streben ins
Minimum der freien Enthalpie und dieses Streben ist aufs Engste mit dem
chemischen Potential µ verknüpft. Allgemein reduziert sich unsere
ursprüngliche Monsterformel zu:
| dG = Vdp - SdT + µ1dn1 + µ2dn2 + ... |
Für konstanten Druck und konstanter Temperatur wird's noch einfacher und wir erhalten
dGp,T = µAdnA + µBdnB = -µAdξ + µBdξ .
wobei das letze Gleichheitszeichen der Reaktion A ↔ B Rechnung trägt. Diese Gleichung kann man umformen zu
(∂G/∂ξ)p,T = µB - µA.
Da die chemischen Potentiale von der Zusammensetzung abhängen, ändern sich ihre Werte, wenn die Reaktion fortschreitet, und damit ändert sich auch die Steigung der Kurve G(ξ). Wenn µA größer als µB ist, ist die Steigung negativ; wenn µB größer als µA ist, ist sie positiv. Die chemische Reaktion verläuft in Richtung abnehmender Freier Enthalpie; daher gilt:
Für µA >
µB läuft die Reaktion in der Richtung A →
B,
für µB >
µA läuft die Reaktion in der Richtung A ←
B.
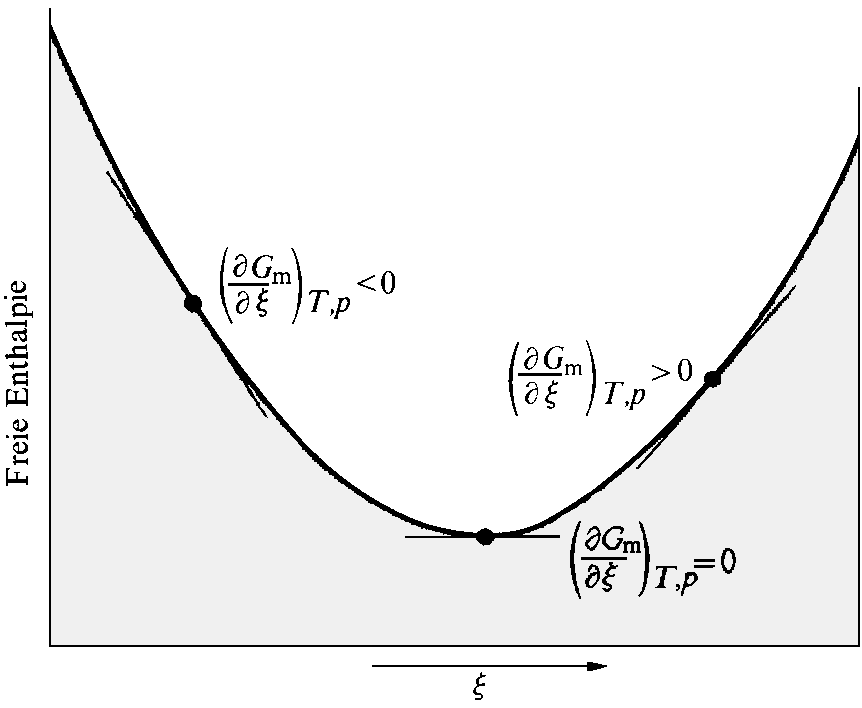 |
| Abb. 1: Bei fortschreitender Reaktion (entsprechend einer Bewegung von links nach rechts auf der horizontalen Achse) ändert sich die Steigung der Kurve der Freien Enthalpie. Im Gleichgewicht ist die Steigung gleich Null; dem entspricht das Minimum der Kurve. |
Bei µA = µB erreicht die Reaktion ihr Gleichgewicht.
Es ist nützlich, die Ableitung (∂G/∂ξ)T,p durch ΔrG = (∂G/∂ξ)T,p (die sogenannte Freie Reaktionsenthalpie oder auch Gibbssche Reaktionsenergie) abzukürzen.
Betrachten wir zum Abschluß den allgemeinen Fall einer Reaktion |νA|A + |νB|B → |νC|C + |νD|D, d.h.
0 = ΣJνJ J
(Die stöchiometrischen Koeffizienten der Edukte sind negativ).
Wenn die Reaktion um dξ fortschreitet,dann ändern
sich die Stoffmengen der Edukte A,B und der Produkte gemäß
| dnJ = νJ dξ |
und die Freie Enthalpie ändert sich (bei konstanter Temperatur
und konstantem Druck):
|
|
Mit der Steigung der Funktion, (∂G/∂ξ)T,p,
erhalten wir die Freie Reaktionsenthalpie:
| ΔrG = ΣJνJ µJ |
Mit der allgemeinen Freien Reaktionsenthalpie kann man in jedem Stadium einer Reaktion angeben, in welche Richtung die Reaktion spontan weitergehen wird:
Für ΔrG
< 0 läuft die Reaktion in der Richtung
νAA+νBB
→νCC+νDD,
für ΔrG
> 0 läuft die Reaktion in der Richtung νAA+νBB ← νCC+νDD,
für ΔrG
= 0 erreicht die Reaktion ihr Gleichgewicht.
Reaktionen mit ΔrG <
0 nennt man exergonisch; sie laufen spontan ab, und man kann sie
dazu verwenden, andere Prozesse anzutreiben. Reaktionen mit ΔrG
>
0 heißen endergonisch. Spontan würden sie in der Gegenrichtung
ablaufen. Für eine Reaktion im Gleichgewicht ist ΔrG
= 0.
![]()
Auf diesem Webangebot gilt die Datenschutzerklärung der TU Braunschweig mit Ausnahme der Abschnitte VI, VII und VIII.