Der einfachste Fall einer zusammengesetzten Reaktion ist der Prozess
A → B mit der Geschwindigkeitskonstanten
k und B → A mit der Geschwindigkeitskonstanten
k', wobei sowohl die Hin- als auch die Rückreaktion, A↔ B,
beide erster Ordnung sein sollen. Ein Beispiel ist die Umlagerung von CH3NC ↔ CH3CN.
Ein nichtchemisches Beispiel ist ein demokratischer Zweiparteienstaat,
bei dem der Wählerfluss von der Anhängerschaft der Partei
A zur Partei B und zurück beschrieben wird (unter Vernachlässigung
der Nichtwähler). Zur Änderung von [A] bzw. [B] tragen zwei Effekte
bei: die Hinreaktion erniedrigt [A] ( erhöht [B]) in der Zeit dt um
k [A], und die Rückreaktion erhöht [A] (erniedrigt [B]) um k'
[B]. Es ändern sich [A] und [B] also insgesamt gemäß
|
|
d[B] /dt = +k[A] - k'[B] |
in der Summe ist d [A]/dt + d[B]
/dt = 0, d. h. die Summe [A] + [B] ist zeitlich konstant. Folglich
muss gelten, dass immer [A]+[B] = [A]o+ [B]o
ist, wenn [A]o und [B]o die jeweiligen Anfangskonzentrationen
charakterisieren. Wir können nun eine Konzentration (z.B. [B]) durch
[B] = [A]o+ [B]o−[A]
ersetzen und gelangen so zur DGL für [A]:
| d [A]/dt = k' ([A]o + [B]o) − (k + k') [A] |
Die Lösung erhält man nach gewohntem
Schema:
| [A] = k' ([A]o+[B]o)/k+k'
+ (k[A]o- k'[B]o)/k+k'
.
e-(k+k')t
[B] = k ([A]o+[B]o)/k+k'-(k[A]o-k'[B]o)/k+k' . e-(k+k')t |
Der zeitliche Verlauf von [A] und [B] ist in der Abbildung dargestellt, wobei angenommen wurde, dass am Anfang [B]o / [A]o = 0.25 war, d.h. zur Zeit t = 0 kommt auf 4 Teile der Substanz A 1 Teil von B. Die Geschwindigkeitskonstante für die Hinreaktion ist viermal so schnell wie für die Rückreaktion gewählt: k = 4k'.
Für sehr große Zeiten erreichen die Konzentrationen ihr Gleichgewicht
(g):
| [A]g = k' ([A]o+[B]o)/k+k'
[B]g = k([A]o+[B]o)/k+k' |
Für das Verhältnis finden wir
| [B]g/[A]g = k/k' = K |
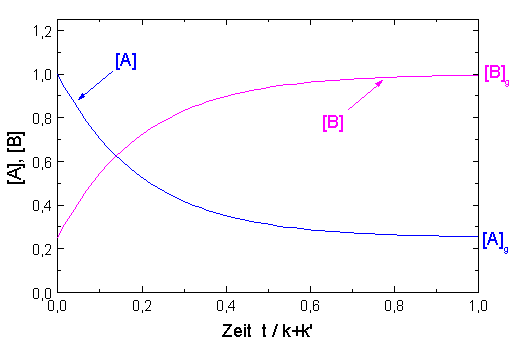 |
| Abb. 1: Zeitlicher Verlauf für den Prozeß A → B mit der Geschwindigkeitskonstanten k und B → A mit der Geschwindigkeitskonstanten k'. Anfangsbedingungen sind [A]o= 4 [B]o und k = 4k'. |
Zu dieser wichtigen Gleichung gelangen wir auch, wenn wir davon ausgehen. dass sich [A] und [B] am Gleichgewicht nicht mehr ändern. Dann können wir d[A]/dt = 0, d[B]/dt = 0 setzen; im Gleichgewicht gilt also k [A] = k' [B], und es folgt direkt unsere Gleichung für die Konzentration im Gleichgewicht.
Diese Gleichung ist ein sehr wichtiges Ergebnis, weil sie den Zusammenhang zwischen einer thermodynamischen Größe, der Gleichgewichtskonstanten, und den Geschwindigkeitskonstanten als kinetischen Größen beschreibt. Man kann insbesondere, wenn man eine der beiden Geschwindigkeitskonstanten (z. B. k) kennt, die andere berechnen, sofern die Gleichgewichtskonstante K bekannt ist.
Im Prinzip kann man bei anderen Gleichgewichtsreaktionen in der gleichen
Weise vorgehen. Nehmen wir an, die Reaktion A + B ↔
C + D sei einfach bimolekular und deshalb in beiden Richtungen zweiter
Ordnung; dann ändert sich [A] bei der Hin- und Rückreaktion mit
den Geschwindigkeiten
| A + B → C
+ D, vA,hin = −k[A][B];
C + D → A + B, vA,rück = k'[C][D]. |
Im Gleichgewicht ist wiederum die Änderung insgesamt gleich Null;
dort gilt also - k[A][B] + k'[C][D] = 0 und damit
|
|
genauso wie im vorigen Fall. Besteht eine Reaktion aus einer Folge von
einfachen Reaktionen, z. B. vom Typ
| A + B ↔
C + D, vA,hin = −ka [A][B],
vA,rück = ka'[C][D],
C ↔ E + F, vC,hin = −kb [C], vC,rück = kb'[E][F]. |
so müssen im Gleichgewicht alle Einzelreaktionen im Gleichgewicht
sein:
| {[C][D]/[A][B]}G1 = ka /k'a, {[E][F]/[C]}G1 = kb /kb'. |
Die Brutto-Reaktion lautet:
|
|
und ihre Gleichgewichtskonstante wird
| K = {[D][E][F]
/[A][B]}G1
= {[C][D][E][F]/[A][B][C]}G1
= {[C][D]/[A][B]}G1 . {[E][F]/[C]}G1 = ka·kb /ka'·kb'. |
Besteht die Brutto-Reaktion aus einer Folge von Einzelschritten, so
gilt allgemein
|
|
wobei k die Geschwindigkeitskonstanten der einzelnen Hinreaktionen und k' diejenigen der einzelnen Rückreaktionen sind.
![]()
Auf diesem Webangebot gilt die Datenschutzerklärung der TU Braunschweig mit Ausnahme der Abschnitte VI, VII und VIII.