Der Teilchen im Kasten - Ansatz wird augenscheinlich
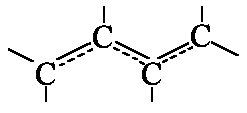 Beim Butadien sind die π-Elektroden delokalisiert; sie können sich
längs der C-C-Bindung (Länge etwa 139 pm) frei bewegen.
Beim Butadien sind die π-Elektroden delokalisiert; sie können sich
längs der C-C-Bindung (Länge etwa 139 pm) frei bewegen.
In konjugierten Systemen ![]() etc. haben die π-Elektronen die ganze Länge
der Kette als Aufenthaltsort zur Verfügung. Sie verhalten sich wie
ein "Elektronengas" in einer Dimension.
etc. haben die π-Elektronen die ganze Länge
der Kette als Aufenthaltsort zur Verfügung. Sie verhalten sich wie
ein "Elektronengas" in einer Dimension.
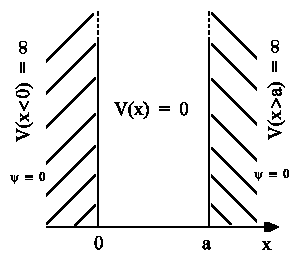 Wir wollen zunächst untersuchen, wie sich ein Elektron verhält. Dazu idealisieren wir unser Polyen
noch etwas weiter. Wir nehmen an, dass sich das Elektron von Ort 0 bis a völlig frei längs der x-Achse bewegen kann, d.h.
Wir wollen zunächst untersuchen, wie sich ein Elektron verhält. Dazu idealisieren wir unser Polyen
noch etwas weiter. Wir nehmen an, dass sich das Elektron von Ort 0 bis a völlig frei längs der x-Achse bewegen kann, d.h.
 Dieses einfache Modell für die Beschreibung von Polyenen entspricht genau der Bewegung eines Teilchens
im Potentialkasten, bei dem das Potential V(x) Innerhalb des Bereichs 0
< x < a Null ist. Im verhergegangenen Abschnitt erhielten wir als normalisierte
Lösung der Schrödingergleichung die Wellenfunktionen zum n-ten Energiezustand:
Dieses einfache Modell für die Beschreibung von Polyenen entspricht genau der Bewegung eines Teilchens
im Potentialkasten, bei dem das Potential V(x) Innerhalb des Bereichs 0
< x < a Null ist. Im verhergegangenen Abschnitt erhielten wir als normalisierte
Lösung der Schrödingergleichung die Wellenfunktionen zum n-ten Energiezustand:
| ψn(x) = √(2/a)·sin (nπx/a) |
wobei den Zuständen folgende diskrete Energien zukommen
| En = h²/8ma² n² mit n = 1, 2, 3, ... |
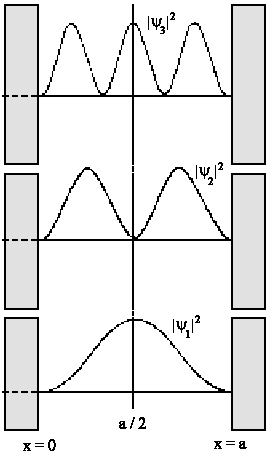
Anhand der Abbildung wird deutlich, dass nur die Wellenfunktionen
möglich sind, die wie bei einer stehenden Welle in die Potentialwände
passen. Der niedrigste Zustand n=1 ist derjenige mit nur einem Bauch und
lediglich Nullstellen an der Wand. Bei jeder energetisch höheren
Lösung kommt immer ein Knoten (ein Nulldurchgang) hinzu.
Bei den Polyenen werden nun alle vorhandenen Quantenzustände ihrer Energie nach mit
Elektronen besetzt. Da Elektronen Fermionen sind und damit dem Paulischen
Ausschließungsprinzip gehorchen müssen, erhalten wir unter
Berücksichtigung des Spins für
| Butadien |
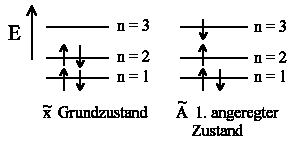 |
Man kann bei Polyenen Absorptionsspektren beobachten und die Anregungsenergie ΔE entspricht dem Energieunterschied zwischen den beiden relevanten Niveaus (n+1) und n. Das im Grundzustand energetisch höchste Niveau, das mit Elektronen besetzt ist, bezeichnen wir als HOMO (highest occupied molecular orbital). Im Falle des Butadien ist dies n = 2. Das energetisch darüber liegende Niveau (also n+1=3 im Falle des Butadiens) wird als LUMO (lowest unoccupied molecualr orbital) bezeichnet. Da für eine Doppelbindung zwei Elektronen benötigt werden und nach dem Pauliprinzip sich die Elektronen voneinander unterscheiden müssen, können wir maximal zwei Elektronen (Spin up und Spin down) pro Quantenzustand n "unterbringen". D.h. die Gesamtzahl der Doppelbindungen entspricht gerade n und wir erhalten für den Energieunterschied ΔE = En+1− En:
ΔE = h²/8ma²[(n + 1)² − n²] = h²/8ma² (2n + 1) = hν = hc/λ
wobei λ der Absorptionswellenlänge entspricht. Wenn wir die Wellenlänge der Absorption messen, dann können wir daraus auch die Kettenlänge a experimentell bestimmen:
aexp2 = (2n+1) λexp. h/8mc
Die Länge einer C-C-Bindung beträgt ca. a0≈
0,139 nm, so dass wir für die Länge der konjugierten Kette akk
= ao.
(2n−1) ansetzen können. Das Experiment liefert:
| n | Stoff | λexp / nm | →aexp / nm | akk / nm |
| 2 | Butadien | 210 | 0,56 | 0,42 |
| 3 | Hexatrien | 247 | 0,72 | 0,70 |
| 4 | Oktatetraen | 268 | 0,88 | 0,98 |
| 5 | Vitamin A | 306 | 1,01 | 1,26 |
| 11 | Carotin | 420 | 1,70 | 2,94 |
Obwohl das Modell extrem einfach ist wurde, gibt es die Tendenz richtig wieder.
Und nun zu den elektrisch leitfähigen Polymeren:
Im Jahr 2000 wurde der Nobelpreis für Chemie für leitfähige
Polymere an A.G. MacDiarmid, A.J. Heeger und H. Shirakawa vergeben. Die
Leitfähigkeit von Metallen beruht darauf, dass den äußeren
Elektronen energetisch höhere unbesetzte Zustände zur Verfügung
stehen, in die sie thermisch - also mittels allgegenwärtiger Wärmeenergie
- angeregt werden können: Bei Metallen grenzen besetzte und darüberliegende
unbesetzte Zustände unmittelbar aneinander. Ganz anders bei Isolatoren:
Hier klafft eine große Lücke zwischen dem höchsten besetzten
Orbital (HOMO) und dem niedrigsten unbesetzten (LUMO). Konjugierte Polymere
nehmen eine Zwischenstellung ein. Wir wollen nun zeigen, dass
der energetische Abstand zwischen HOMO und LUMO mit wachsender Kettenlänge
gegen null geht:
Setzen wir nämlich in unsere Gleichung für den Energieabstand zwischen LUMO und HOMO, ΔE = h²/8ma² (2n+1), die Länge der konjugierte Kette mit a = ao·(2n−1) ein, dann ergibt sich:
ΔE = h²/8mao² · (2n+1)/(2n-1)²
Für große n ist ΔE = h²/6mao² · 1/n , d.h. ΔE wird mit zunehmender Kettenlänge immer kleiner und die Leitfähigkeit nimmt zu, da die äußeren Elektronen immer leichter in die unbesetzten höheren Zustände gelangen können.
Genauere quantenchemische Betrachtungen zeigen jedoch, dass die Lücke zwar kleiner wird, aber bestehen bleibt, weshalb undotiertes Polyacetylen mit einer Leitfähigkeit von 10−7 bis 10−5 Siemens pro Meter nur ein Halbleiter ist. Der Grund dafür ist, dass wie bei der konventionellen Strichdarstellung von Polyacetylen jede zweite Bindung Doppelbindungscharakter hat.
Eine Dotierungssubstanz wie Iod sorgt dafür, dass mitten in der Bandlücke ein neuer Zustand auftritt, der entweder Elektronen aus dem HOMO aufnehmen oder an das LUMO abgeben kann und so die Leitfähigkeit erhöht.
![]()
Auf diesem Webangebot gilt die Datenschutzerklärung der TU Braunschweig mit Ausnahme der Abschnitte VI, VII und VIII.