Der harmonische Oszillator
 |
Die potentielle Energie eines zweiatomigen Moleküls hat in einer gewissen Entfernung ein Minimum. Die Entwicklung der potentiellen Energie V(x) in eine Potenzreihe bezüglich der Gleichgewichtslage x0(für die dV(x)/dx|x0 = 0 ist) führt zu V(x) = V(0) + ½ d²V(x)/dx²|x0 x2. Wählen wir als Nullpunkt der Energiezählung V(0) und kürzen die Konstante d²V(x)/dx²|x0 mit k ab, dann erhalten wir als Näherung für das Potential
V(x) = ½ kx² (x mißt Auslenkung aus Gleichgewicht)
Die Schrödingergleichung ist dann
(−h²/2md²/dx²
+ ½ kx²) y
= E y
Da A und B gegeneinander schwingen, müssen wir noch m durch die
reduzierte Masse µ = mAmB/mA+mB
ersetzen.
Führen wir die neue Abstandsvariable z² = x² √(kµ/h²) ein,
dann erhalten wir schließlich die Schrödingergleichung für
die Schwingung:
(−d²/dz²
+ z²) y(z) =
2
E/hw·y(z)
wobei die Schwingung durch die Kreisfrequenz ω charakterisiert wird. Diese ist beim Harmonischen Oszillator durch ω =√(k/μ) mit der Kraftkonstanten k und der reduzierten Masse μ verbunden. Wer sich für einen netten und zukunftsweisenden mathematischen Lösungsweg interessiert, kann ihn hier finden.
Allgemein gilt für die möglichen Energieniveaus:
| En = |
wobei n die ganzzahligen Werte n = 0, 1, 2, .... annehmen kann.
Die Energie des Grundzustandes Eo = ½ hw
bezeichnet man als Nullpunktenergie. Für die Wellenfunktion dieses
energetisch niedrigsten Zustandes erhält man eine Gaußfunktion:
Im Grundzustand ist danach die größte Aufenthaltswahrscheinlichkeit
in der Gleichgewichtslage (bei z=0). Für die Wellenfunktion des n-ten
Zustandes erhält man allgemein
| yn(z) = Cn Hn(z) e−z²/2 |
wobei die Konstante Cn über die Normierungsbedingung
-¥ò+∞yn*
yn
dz = 1 bestimmt wird:
| Cn = 1/(π½n!2n )½ |
und die Funktionen Hn(z) bezeichnet man als Hermitesche
Polynome:
| H0(z) = 1 |
| H1(z) = 2z |
| H2(z) = 4z2 − 2 |
| H3(z) = 8z3 − 12z |
| H4(z) = 16z4 − 48z2 + 12 |
| H5(z) = 32z5 − 160z3 + 120z |
| H6(z) = 64z6 - 480z4 + 720z2 − 120 |
 |
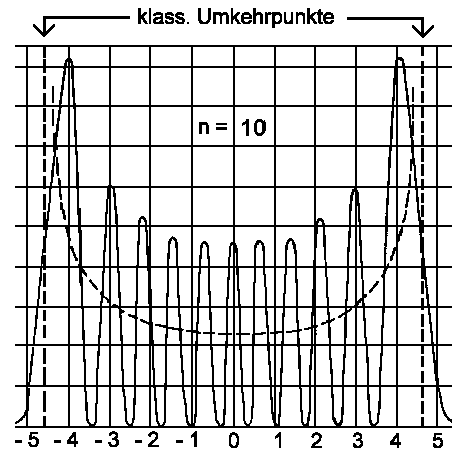 |
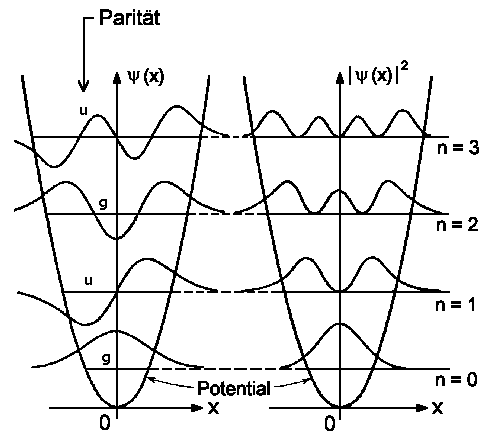
| Wellenfunktion (links) und Aufenthaltswahrschein- lichkeit (rechts) für die vier niedrigsten Schwingungs- zustände. | Aufenthaltswahrscheinlichkeit für den Schwingungszu- stand n=10. Die gestrichelte Kurve gibt die klassische Aufenthaltswahrscheinlichkeit wieder. |
Im Grundzustand ist die größte Aufenthaltswahrscheinlichkeit
in der Gleichgewichtslage. Mit zunehmender Vibration wird |yn|2
immer größer im Bereich der klassischen Umkehrpunkte E = V(x).
Der Verlauf der Wahrscheinlichkeitsdichte bei einem klassischen
Oszillator ist durch 1/w(xm²−x²)½
gegeben. Diese Größe (s. gestrichelte Kurve in der rechten Abbildung)
gibt die Wahrscheinlichkeitsdichte an, das Teilchen im Intervall [x, x+dx]
zu finden; d.h. die größte Chance liegt bei den klassischen
Umkehrpunkten xm vor. Wir finden also, dass mit zunehmender
Quantenzahl eine klassische Beschreibung erreicht wird.
![]()
Auf diesem Webangebot gilt die Datenschutzerklärung der TU Braunschweig mit Ausnahme der Abschnitte VI, VII und VIII.