des Wasserstoffatoms
Ausgangspunkt ist unsere DGL für R(r), die wir vor Ableitung der Drehimpulsquadrats-Eigenfunktion Yl,m(J,j) gewonnen hatten:
[−h²/2µ
1/r² ∂/∂r(r²
∂/∂r)
+ V(r) + h²l(l+1)/2µr²−
E] R(r) = 0
Für das Potential eines Elektrons im Z-fach geladenen Kern gilt
V(r) = −Ze²/4peo1/r
. Multiplikation mit −2µ/h²
ergibt:
d²/dr² R
+ 2/r dR/dr
+ [2µE/h²
+ 2µ/h²Ze²/4peo1/r−l(l+1)/r²]
R = 0
Zur einfacheren Schreibweise führen wir nun einige Abkürzungen ein und kennzeichnen die Ableitungen durch Striche (R' ≡d R/dr ):
ρ = 2 ε
r B = Ze²µ/4peoh²ε
ε² = −2µE/h²
(Bindungsenergie)
| R'' + 2/ρ R' − [¼ − B/ρ + l(l+1)/r ²] R = 0 |
Für große Entfernungen (ρ →∞) entfallen alle 1/r ,1/r ² -Terme:
R'' − R/4≈ 0 → R(ρ) = C e−ρ/2 oder R(ρ) = C e+ρ/2
Die zweite Lösung entfällt, da dann R(ρ)
im Unendlichen nicht beschränkt ist, sondern unendlich groß
wird.
Die detaillierte Lösung steht auf einem anderen Blatt; hier die
Kurzform:
Mit dem Lösungsansatz
gehen wir in die DGL und vergleichen die Koeffizienten von ρk (die DGL muss für jedes r und daher jedes ρk gelten), dann erhält man:
ck+1/ck = (l + k + 1 −B)/(k + 1)(k + 2l + 2)
Die Reihe beginnt bei k = 0. Sie muss irgendwo abbrechen, damit
R nicht über alle Grenzen wächst, d.h. es muss ein Koeffizient
Null werden:
| l + k + 1 | − B = 0 |
| ½¾¯¾½ | |
| n |
l, k, 1 sind ganze Zahlen, d.h. n = l + k + 1 muss
eine ganze Zahl sein
| n = 1, 2, 3, 4 ...
0 ≤ l ≤ n −1 |
da l, k = 0, 1, 2, 3....
n wird Hauptquantenzahl genannt |
Einsetzen der Abkürzungen für B = n ergibt:
| En = −µ/2(Ze²/4peo |
Die Energie ist also gemäß der Hauptquantenzahlen n quantisiert; die möglichen Werte für den Drehimpuls sind l = 0, 1, 2, ..., n−1 und für jedes l gibt es (2l+1) m-Werte.
Für n = 1 ist l = 0, k = 0 → R(ρ) = C e−ρ/2
oder nach Einsetzen für r = (2Z/aon) r : R(r) = C e−Zr/nao
mit der Abkürzung (Bohrscher Radius) ao
= 4peoh²/µe²
Das Polynom Σ ckρk im Lösungsansatz R(ρ) = e−ρ/2.ρlΣk=0 ckρk wird als assoziiertes Laguerresches Polynom(Σk=0 ckρk ≡ Ln-l-12l+1(ρ)) bezeichnet. Häufig gibt es ab hier ein heilloses Durcheinander, da in manchen Lehrbüchern die Laguerrschen Polynome etwas anders definiert sind. Wir halten uns hier an die mathematische Form, die auch das Programmpaket "Mathematica" benutzt. Und so lässt sich jedes beliebige assoziierte Laguerrsche Polynom Lpq(x) berechnen (Rodrigues Darstellung):
Für Mathematica-Besitzer ist es ganz einfach. Die nachfolgende
Programmzeile druckt die ersten 5 assozierten Laguerreschen Polynome (wer
höhere Polynome sehen möchte, ersetze 5 durch die höhere
Zahl):
Do[Print[ "n=",n," l=",l," " , LaguerreL[n-l-1,2l+1,x]],{n,1,5},{l,0,n-1}]
Die Tabelle der niedrigsten Polynome zeigt, dass dies wirklich einfache
Funktionen sind:
| Elektron | n | l | Ln-1-12l+1 (x) |
|
2 p 3 d 4 f |
1
2 3 4 |
0
1 2 3 |
1
1 1 1 |
| 2 s
3 p 4 d |
2
3 4 |
0
1 2 |
2 - x
4 - x 6 - x |
| 3 s
4 p |
3
4 |
0
1 |
6 - 6x + x²
20 - 10x + x² |
| 4 s | 4 | 0 | 24 - 36x + 12x² - x³ |
Die gesamte Lösung für den Radialanteil der Wellenfunktion
nimmt dann die Form
| Rn,l = Cn,l ·ρl. e−ρ/2 Ln-1-12l+1(ρ) |
an, wobei die Konstanten Cn,l (nicht zu verwechseln mit den
Koeffizienten ck unserer Reihenentwicklung) noch als Normierungsfaktor
festgelegt werden muss. Diese ergeben sich aus der Normierungsbedingung:
| oò¥ Rn,l · Rn,l · r² dr = 1 |
Wenn wir jetzt ρ durch r ersetzen, r
= (2Z/aon)
r, dann ergibt sich als vollständige Lösung:
| Rn,l = {4(n−l−1)! Z³/[(n+l)!]n4ao³}½ (2Zr/nao)l e−Zr/nao Ln-l-12l+1(2Zr/nao) |
wobei wir wieder
| ao = 2 r Z/n
ρ
= |
Die Wellenfunktionen Rn,l(r) und die Wahrscheinlichkeit
das Elektron in der Entfernung r vom Kern zu finden, Rn,l2r2
sind
in der nachfolgenden Abbildung dargestellt:
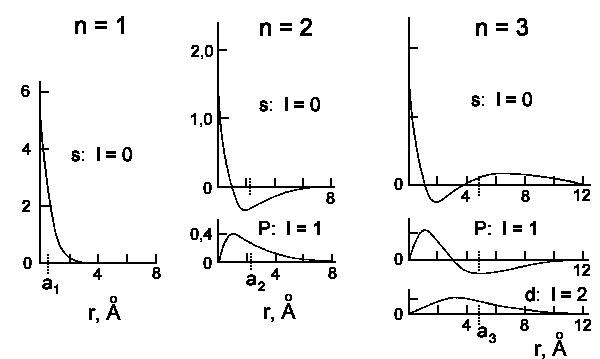 |
| Radiale Wellenfunktionen von Wasserstoff für n = 1, 2 und 3. Die
Ordinate ist immer
[Rn,l(r) m−3/2]·10−8. |
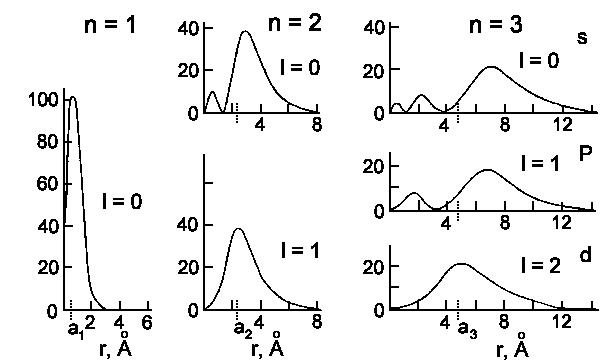 |
| Radiale Wahrscheinlichkeit im Wasserstoff für n = 1, 2, and 3. |
Darstellungen der Gesamtwellenfunktion y(r,J,j) = R(r)
.Y(J,j) für wasserstoffähnliche
Atome findet man im nächsten Kapitel.
![]()
Auf diesem Webangebot gilt die Datenschutzerklärung der TU Braunschweig mit Ausnahme der Abschnitte VI, VII und VIII.