Die nächste Periode beinhaltet 8 Elemente. Zunächst wird mit Na und Mg die (3s)-Schale gefüllt, dann die 3p-Schale mit Al, Si, P, S, Cl und schlie▀lich zum Schalenabschluss Ar. Diese Elemente haben die gleichen spektroskopischen Grundzustandsterme wie die Periode Li, Be,...Ne und verhalten sich chemisch sehr ähnlich. Die Ionisierungsenergien sind in dieser Serie etwas kleiner (s. Kapitel "Konfiguration aller Elemente").
Es überrascht ein wenig, dass die Periode mit Argon abgeschlossen ist, obwohl die 3d-Schale noch nicht aufgefüllt ist. Jedoch ist die Energieaufspaltung zwischen 3p und 3d bereits so groß, dass die 3d-Elektronen energetisch an die 4s-Elektronen herankommen. Der Energieunterschied 4s - 3d ist sogar so minimal, dass eine Konkurrenz zwischen den Orbitalen auftritt und wir erhalten: 4s, 4s2, 4s23d, 4s23d2, 4s23d3, 4s3d5, 4s23d5, 4s23d6, 4s23d7, 4s23d8, 4s3d10, 4s23d10. Dann wird die 4p-Schale gefüllt und die Periode endet mit Krypton (z = 36).
Die bisherige Reihenfolge von z = 19 bis z = 36 mit dem Auffüllen der 4s, 3d und 4p Orbitale wiederholt sich vom 37. bis zum 54. Element mit dem Auffüllen der 5s, 4d und 5p Orbitale und endet beim Xenon.
Mit den beiden nächsten Elementen, Cäsium und Barium, wird die 6s Schale besetzt und dann beim Lanthan mit der Besetzung der 5d-Orbitale begonnen. Doch bereits mit dem nächsten Element, dem Cer, beginnt der Aufbau der 4f-Schale. Mit dem 71. Element, Lutetium, ist der Aufbau der 4f-Schale abgeschlossen. Die Bindungsenergie der 4f-Elektronen liegt im gleichen Bereich wie die der 5d-Niveaus, so dass leichte Variationen bei der Zuordnung auftreten können. Die irregulären Besetzungen von z.B. Pd und Gd (Gadolinium) lassen sich im einzelnen nur durch die Berechnung der Energie klären.
Mit dem 72. Element wird jedenfalls die 5d-Schale bis zum Quecksilber aufgefüllt. Das Auffüllen der 6p-Orbitale endet dann mit Ru (z = 86).
Die nächste Reihe wird prinzipiell genauso aufgebaut wie Z = 55
bis Z = 86 (Cs - Ru); also zunächst 7s, dann im "Mischverfahren" 6d
↔
5f. Doch leider "versagt" nun bald die Kernphysik, denn die Atomkerne werden
immer instabiler und kurzlebiger, so dass keine experimentellen Werte
über die Elektronenhülle mehr vorliegen. Jedoch wird nicht bezweifelt,
dass der Aufbau der Elemente nach dem gleichen Prinzip fortgesetzt
wird und danach bei z = 118 das nächste Edelgas auftritt. Die vermuteten
Konfigurationen
bis Z = 112 sind im folgenden Kapitel mit aufgeführt.
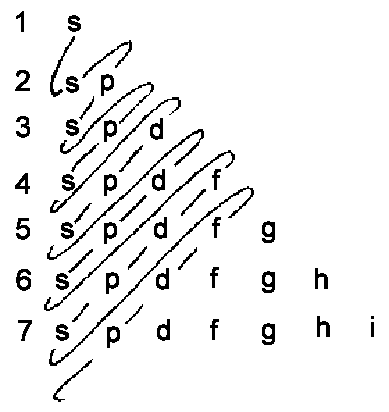 |
| Zuletzt noch ein einfaches Merkschema für die energetische Reihenfolge der Besetzungszustände dargestellt durch die geschlungene Kurve. |
![]()
Auf diesem Webangebot gilt die Datenschutzerklärung der TU Braunschweig mit Ausnahme der Abschnitte VI, VII und VIII.