Nach dem einfachen Stossmodell findet eine Reaktion dann statt, wenn die beiden Edukte A+B zusammenstossen. Beispiele für eine recht gute Übereinstimmung sind die Reaktionen vom O(1D)-Atom mit H2O, bei der die Geschwindigkeitskonstate k recht gut mit der
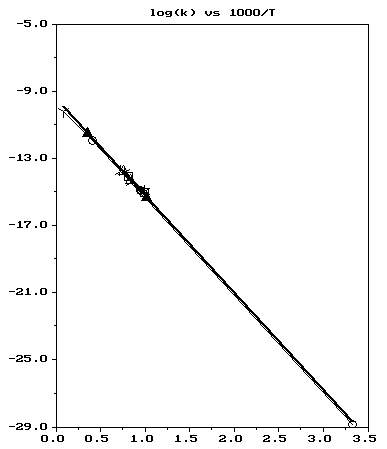 |
| Abb.1: Die Temperaturabhängigkeit der Reaktion H+CO2→ OH+CO. Ergibt die Auftragung von ln k gegen 1/T eine Gerade, dann wird k(T) durch die Arrhenius-Gleichung beschrieben. |
| k = A e−Ea/RT |
Man kann diese Gleichung auch in der Form
ln k = ln A − Ea/RT
schreiben. Danach erhält man eine Gerade, wenn man ln k gegen
1/T
aufträgt. A nennt man den präexponentiellen Faktor
oder
auch Frequenzfaktor,
Ea die Aktivierungsenergie.
In der Tabelle sind einige experimentelle Werte zusammengestellt:
| Arrhenius-Parameter | ||
| (1) Reaktionen
erster Ordnung |
A / s-1 | Ea / kJ mol-1 |
| N2O5 → NO2
+ NO3
CH3NC → CH3CN 2 N2O5 → 4 NO2 + O2 |
1,2 · 1015
3,8 · 1013 6,31 · 1014 |
92,8
161 88 |
| (2) Reaktionen
zweiter Ordnung |
A | Ea / kJ mol-1 |
| O + H2 →
OH + H
OH + H2 → H2O + H H + CO2 → OH + CO C2H5ONa + CH3I in Ethanol |
7,1· 10-11 Molek-1s-1
3,5· 10-10 Molek-1s-1 8,0 · 1010mol-1s-1 2,4 · 1011 mol-1s-1 |
109,6
41,1 42,0 81,6 |
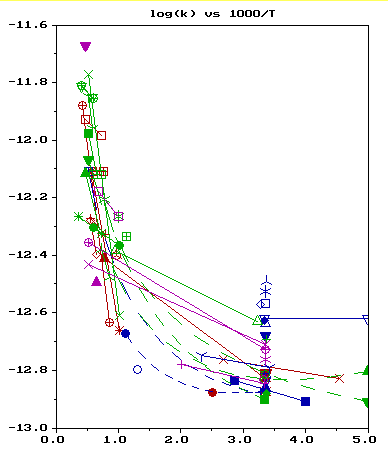 |
| Abb.2.: Die Temperaturabhängigkeit der Reaktion OH+CO ® H+CO kann nicht durch die Arrheniussche Gleichung beschrieben werden, da eine Auftragung aller gemessenen k(T)- Werte in der Form ln k(T) gegen 1/T keine Gerade ergibt. |
In manchen Fällen gehorcht die Temperaturabhängigkeit nicht
der Formel von Arrhenius. Ein Beispiel hierfür ist die Reaktion OH+CO
→
H+CO, deren Geschwindigkeitskonstante - aufgrund der atmosphärischen
Bedeutung - sehr häufig gemessen wurde (Abb.2). Gründe hierfür
sind die Nichtberücksichtigung der inneren Energien der Edukte (die
Stosstheorie berücksichtigt nur die kinetische Energie des Stosses)
und der sogenannte Sterische
Faktor S, der berücksichtigt, dass Moleküle nur dann
reagieren könne, wenn die räumlich Anordnung dies zulässt.
Im einfachen Beispiel der Reaktion Br + HI →
HBr + I ist klar, dass HBr nur dann entstehen kann, wenn das Br auf das
H-Atom im HI-Molekül stösst und nicht auf das I-Atom. Einige
kleine Filmchen zur Illustration des Sterischen Faktors gibt's hier.
Die leicht modifizierte Arrheniussche Gleichung lautet danach:
| k = S·A e−Ea/RT |
![]()
Auf diesem Webangebot gilt die Datenschutzerklärung der TU Braunschweig mit Ausnahme der Abschnitte VI, VII und VIII.