der Absorptionsquerschnitt
Das Beer-Lambertsche Gesetz gibt an, dass von der eingestrahlten Intensität I0 [Photonen cm-2s-1] nach einer Länge l nur die Intensität IT transmittiert wird, wenn die Absorption durch die N Moleküle/cm3 bei der eingestrahlten Wellenlänge durch den (differentiellen) Absorptionskoeffizienten σ beschrieben wird (s. Beispiel Abb.1):
IT = I0 e-s·N·l
Es gibt noch jede Menge anderer Schreibweisen, wovon die Gebräuchlichste für Flüssigkeiten durch
IT = I0 10-e·c·l
gegeben ist, wobei c die Konzentration [mol/dm3] und ε der Extinktionskoeffizient (s. Beispiel Abb.2) ist.
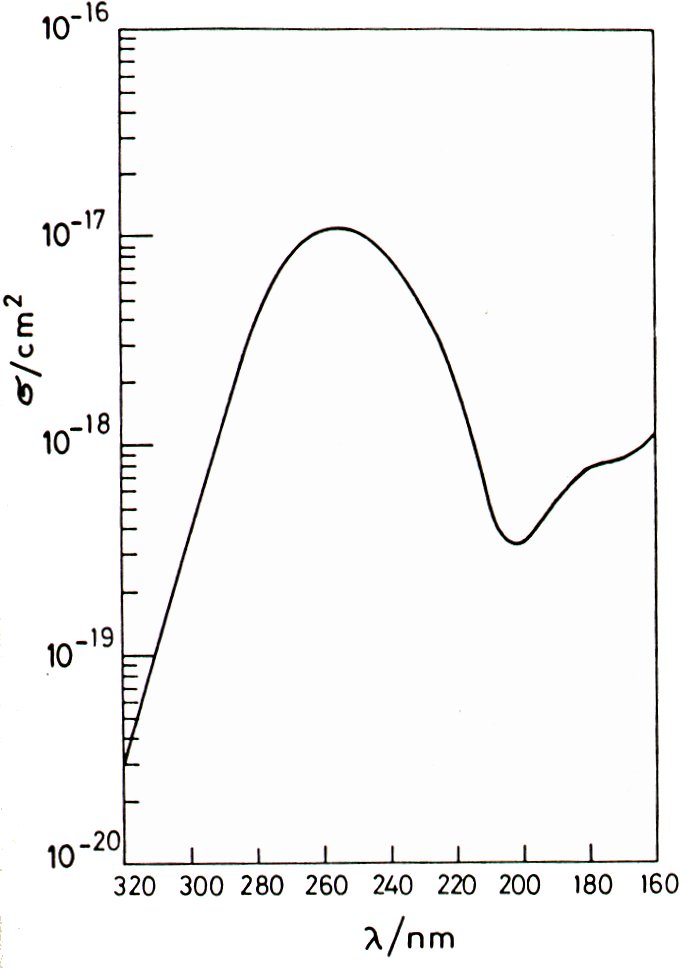 |
| Abb.1: Absorptionsquerschnitt von Ozon im UV. |
Die Chemiker lieben die letzte Schreibweise, da hier das vertraute Mol als Einheit auftaucht. Die "Dynamiker" bevorzugen die erste Schreibweise, da hier nur ein Molekül zu betrachten ist. Natürlich sind alle Schreibweisen des Beer-Lambert Gesetzes gleichwertig und können ineinander umgerechnet werden (wobei - dank unterschiedlicher Einheiten - beliebig viele Fehler gemacht werden können, insbesondere wenn die Basis nicht e sondern 10 ist).
Der Absorptionsquerschnitt von Ozon ist als Funktion der Wellenlänge
ist in Abb. 1 dargestellt. Gehen wir nun mal davon aus, dass im Mittel
ca. 1012 O3-Moleküle/cm3 vorhanden
sind und bei 270 nm σ = 10-17 cm2
ist, dann ist σ·N = 1·10-5cm-1,
d.h. nach ~
1/1·10-5cm-1
=
1 km ist die Intensität bereits auf 1/e abgefallen
und nach 12 km kommt weniger als ein Millionstel (e-12) der
Strahlung an, d.h. das Sonnenlicht ist bei dieser Wellenlänge nahezu
vollständig absorbiert worden. Nur wenn der Absorptionsquerschnitt
sehr klein ist, wie z.B. oberhalb 310 nm, dann erreicht noch etwas UV-Licht
die Erdoberfläche. Nimmt die Ozonkonzentration ab, dann erreicht auch
immer kürzerwelligere Strahlung die Erdoberfläche.
 |
 |
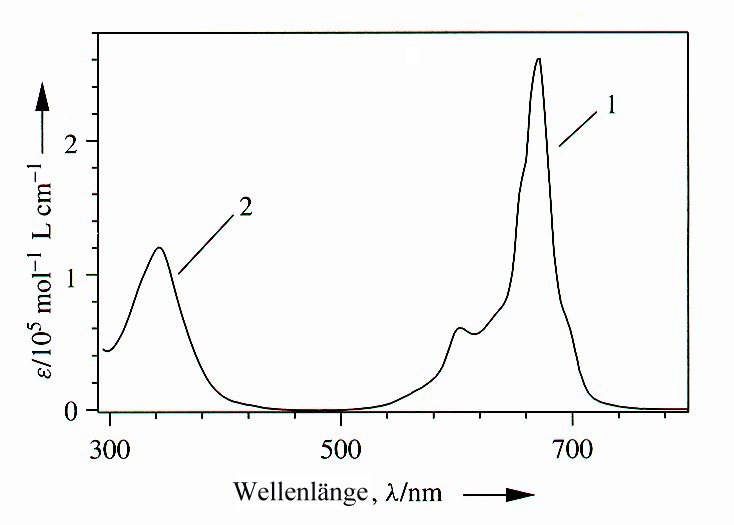
| Abb. 2a: Extinktion
des nebenstehenden blauen Farbstoffmoleküls. Die
blaue Farbe ist eine Folge der Absorption (1) im roten Teil des sichtbaren Spektrums (um 670 nm). Die zweite Absorptionsbande (2) liegt im nahen UV-Bereich. |
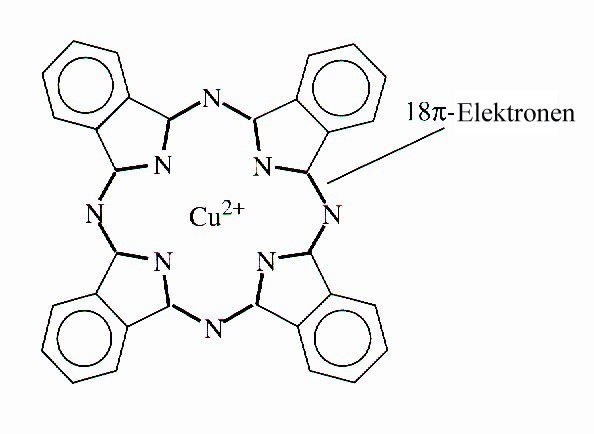
Abb. 2b: Cu2+phthalocyanin
wird häufig als Färbe-
mittel in der Industrie verwendet. |
![]()
Auf diesem Webangebot gilt die Datenschutzerklärung der TU Braunschweig mit Ausnahme der Abschnitte VI, VII und VIII.