Im vorhergehenden Abschnitt haben wir unseren quantenmechanischen Ansatz benutzt, um das Problem der Benzol-Struktur mit seinen sechs gleichwertigen CC-Bindungen zu lösen. Hierüber hatten sich Chemiker des 19. Jahrhunderts die Köpfe zerbrochen. Allerdings werden sich Linearkombinationen von Wellenfunktionen als Beschreibung für Systeme von Elektronen in der Umgebung eines Gerüsts von Atomkernen auch im fundamentalen Fall einer Bindung bewähren, dem molekularen Wasserstoff, also ein zwei Elektronen in der Umgebung zweier Protonen. Vorab wollen wir jedoch das einfachste denkbare System betrachten, welches wir erhalten, wenn wir uns vorstellen, dass ein einzelnes Proton in die Sphäre eines Wasserstoffatom eindringt. Die Elektrostatik sagt vorher, dass es zu einer Abstossung der beiden Protonen kommt. Uns interessiert allerdings, ob das einzelne Elektron als eine Art Kitt dient, also ein System aus drei Teilchen erhalten wird. Am Ende wird unser Modell die Annahme, dass ein stabiles Molekülkation H2+ existiere, stützen.
| Basiszustände | Linearkombination | |
| |1> | 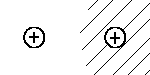 |
In völliger Analogie zum Benzol können wir die Wellenfunktion
des Elektrons im H2+-Kation beschreiben als
 |
| |2> | 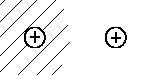 |
|
Basiszustände: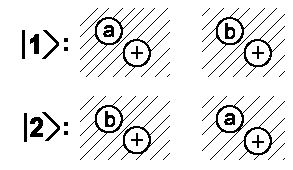 |
Wie im Fall des H2+-Kations kann es bei der Annäherung von zwei Wasserstoffatomen zum Austausch der Elektronen kommen. Somit werden die Elektronenenergien im wellenmechanischen Modell immer weiter aufspalten. | 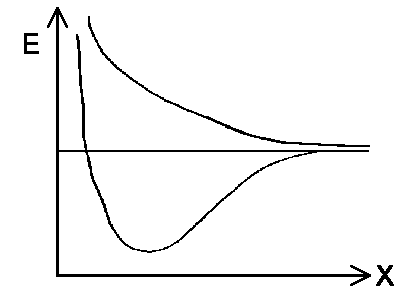 |
Doch halt! Wir haben die Elektronen a und b unterschieden und müssen berücksichtigen, dass es sich bei ihnen um Fermiteilchen handelt. Deswegen muss die Gesamtwellenfunktion ihr Vorzeichen umkehren, wenn man die beiden Elektronen vertauscht. Betrachten wir nun zwei Elektronen mit gleicher Spinausrichtung, ändert die Vertauschung das Vorzeichen nicht. Die Bedingung wird also durch die verwendete Linearkombination zu erfüllen sein. Tatsächlich führt bei |II> = 1/√2 (|1> − |2>) ein Vertauschen der Elektronen zu einer Wellenfunktion |II'> = 1/√2 (|2> − |1>) =−|I>.
Da |II> der Zustand mit höherer Energie ist, werden sich die beiden H-Atome immer abstoßen. Es gibt also kein H2 mit parallelem Elektronenspin. Haben die beiden H-Atome unterschiedlichen Spin, existiert eine bindender Zustand. Der Gesamtspin der beiden Elektronenentspricht Null.
Die Zwei-Elektronen-Bindung ist die häufigste Valenzbindung. Die obigen Überlegungen gelten allerdings ebenso, wenn die Anziehung eines Elektrons zu einem Kern viel größer ist als zu den anderen (z.B. NaCl). Alle Abstufungen zwischen kovalenter und ionischer Bindung sind möglich und können mit diesem Zwei-Elektronen-System erklärt werden.
![]()
Auf diesem Webangebot gilt die Datenschutzerklärung der TU Braunschweig mit Ausnahme der Abschnitte VI, VII und VIII.