Dank des Doppelspaltexperiments
kennen wir bereits ein wesentliches Prinzip der Quantenmechanik, nämlich
dass sich die richtige Wahrscheinlichkeitsamplitude zur Beschreibung
eines Systems als Linearkombination
der Einzelamplituden darstellen läßt. Wir wollen es uns
einfach machen und ein System mit nur zwei Zuständen betrachten, das
uns aber sehr viele Phänomene in der Spektroskopie und Chemie erklären
kann (eine allgemeine Behandlung gibt's hier).
Wir können uns z.B. Benzol durch folgende elektronische Struktur zusammengesetzt
denken:
| Benzol ≡ | 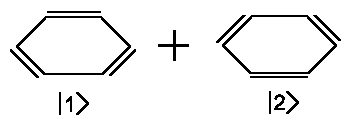 |
&psiBenzol = a1&phi1+ a2φ2 |
HψBenzol = E ψBenzol
Nun der "Trick": Ausklammern und
Das letzte Gleichheitszeichen ergibt sich, da <1|1> = 1 und <1|2> = 0 ist, denn die Zustände sollen orthonormal sein. Die Größen <1|H|1> und <2|H|2> sind die Energien von Benzol nur in der Konfiguration |1> bzw. |2>, die wir wie gesagt mit Eo abkürzen wollen. <1|H|2> und <2|H|1> ist ein Maß dafür, wie groß die Chance ist, dass das System von der Konfiguration |2> in die Konfiguration |1> bzw. von der Konfiguration |1> in die Konfiguration |2> = übergeht. Offensichtlich geht es von der einen zur anderen Konfiguration genauso gut (oder schlecht) wie von der anderen zur einen, d.h. es gilt sicherlich: <1|H|2>= <2|H|1>, wofür wir die Abkürzung W wählen. Wir erhalten dann die zwei Gleichungen (die wir nach a1/a2 auflösen):
| Eo a1 + W a2 = E a1 | → | a1/a2 = W/E − Eo | }gleichsetzen |
| W a1 + Eo a2 = E a2 | → | a1/a2 = E − Eo/W | |
| → W · W = (E − Eo) ( E − Eo) | |||
| → (E− Eo)2 = W2 | |||
| → EI,II = Eo ± W | |||
Es gibt also zwei stationäre Energiezustände EI und EII, von denen der eine Zustand energetisch tiefer liegt als der Ausgangszustand Eo und der andere liegt um den gleichen Betrag W höher als Eo. Gewöhnlich bezeichnet man den energetisch tieferen Zustand mit EI und den energetisch höheren mit EII, so dass wir eigentlich das ± umdrehen müßten; aber so pingelig wollen wir nicht sein. Falls W = 0 ist, also irgendwelche Wechselwirkungen zwischen den Zuständen |1> und |2> nicht stattfinden, dann entsprechen EI und EII dem Energiewert Eo der ungestörten Zustände. Die Wechselwirkung W bezeichnen wir mit ΔE. Die Energie der stationären Zustände |I> und |II> beträgt dann
| EI,II = Eo ±ΔE | 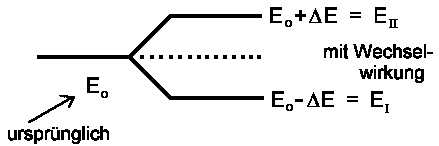 |
Wir haben nun die Energie für die stationären Zustände
|I> und |II>. Doch
wie sehen diese Zustände aus? Nun, wir brauchen nur in der obigen Formel a1/a2
= E − Eo/W
für E unsere neuen Energien EI,II =
Eo±W einsetzen und erhalten sofort:
a1= ±a2, was
wir uns schon eingangs überlegt hatten. Führt man noch die Normierung
durch, d.h. <I|I>=1, bzw. <II|II>=1, dann kommt man schnell zur
Lösung:
| |I> = 1/√2(|1> + |2>) |II> = 1/√2(|1>−|2>) |
Alle diese Überlegungen gelten nicht nur für Benzol, sondern
auch z.B. für das Ammoniakmolekül. Energiediagramme zeigt und eine praktische Anwendung behandelte
der Abschnitt Ammoniak. Bei diesem Molekül
machen sich nämlich Übergänge zwischen zwei möglichen
Zuständen bemerkbar:
| |NH3> | |1> | |2> | ||
| N-Atom oberhalb | 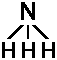 |
unterhalb |  |
der Wasserstoffatome |
Beim Benzol ist die Wechselwirkungsenergie groß, denn das leichte Elektron kann schnell zwischen den beiden Konfigurationen hin-und herwechseln. Das "Durchschwingen" beim Ammoniakmolekül erfolgt aufgrund der um mehrere Größenordnungen höheren Masse erheblich langsamer, d.h. die Wechselwirkungsenergie ist erheblich kleiner. Tatsächlich liegt der elektronische Übergang beim Benzol im UV und beim NH3 im fernen IR. In der folgenden Einheit werden wir denselben Ansatz zur Beschreibung des Wasserstoffmoleküls und des H2+ benutzen.
![]()
Auf diesem Webangebot gilt die Datenschutzerklärung der TU Braunschweig mit Ausnahme der Abschnitte VI, VII und VIII.