Der Aufbau des periodischen Systems der Elemente wird im wesentlichen durch das Pauli'sche Ausschließungsprinzip (Wolfgang Pauli) erklärt, das wir bereits früher kennen gelernt haben. Auf ein Atom angewandt lautet es:
"Elektronen in einem Atom müssen durch einen unterschiedlichen Satz von Quantenzahlen (n, l, ml, ms) repräsentiert sein."
Diese Regel ist ein spezieller Fall von der allgemeinen Aussage:
| Die Gesamtwellenfunktion eines Systems von Elektronen muss antisymmetrisch sein. |
Ohne die mathematischen Auswirkungen des Pauliprinzips zu behandeln, wollen wir es nutzen, um die elektronische Konfiguration von Atomen zu bestimmen (Eine kleine Einführung in Mehrelektronensysteme gibt' hier).
Vom Wasserstoffatom wissen wir, dass bei einem Elektron für
jeden Wert von n die möglichen Werte von l = 0,1,2,...,n sind.
Für jeden Wert von l gibt es 2l + 1 Werte von ml
und für jedes ml zwei Werte von ms (=
±½
; Spin up und Spin down), da s = ½ ist.
| Drehimpuls l: | 0 | 1 | 2 | 3 | 4 | 5 |
| Symbol: | s | p | d | f | g | h |
| max. Besetzung, 2(2l + 1): | 2 | 6 | 10 | 14 | 18 | 22 |
Der Aufbau der ersten 10 Elemente ist qualitativ im folgenden Blockdiagramm dargestellt:
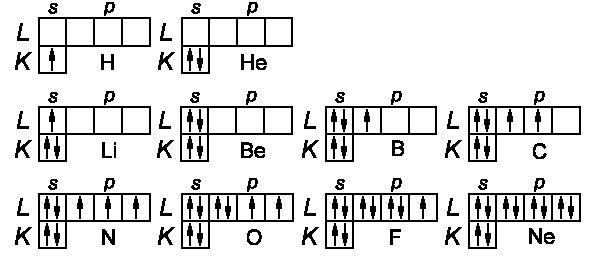
Die s-Unterschale hat einen Block für zwei Elektronen mit entgegengesetztem
Spin; die p-Unterschale besteht aus drei Blocks (ml =
−1,
0, +1) mit jeweils max. zwei Spinzuständen. Die Ausrichtung der Spins
und der J-Werte für den Gesamtdrehimpuls kann durch die beiden folgenden
empirischen Regeln (Friedrich
Hund) gefunden werden:
Hundsche Regeln:
Und hier ein Schmankerl besonderer Güte für alle Java-fähigen Browser: Periodic Table. 1. Sahne; ein MUSS für jeden Chemiker!
![]()
Auf diesem Webangebot gilt die Datenschutzerklärung der TU Braunschweig mit Ausnahme der Abschnitte VI, VII und VIII.