Wir wollen nun etwas genauer das Beispiel des Lithiumhydrids betrachten, wobei die LCAO-Darstellung der Molekülorbitale im Mittelpunkt stehen soll. Ab initio-SCF-Rechnungen mit minimaler Basis (als Li-Basis wird ein Satz der Wellenfunktionen Φ1s, Φ 2s, Φ 2p bezeichnet, die H-Basis mit 1s erscheint im folgenden als ΦH) führen nach Ransil (1960) zu den folgenden Molekülorbitalen (eine geringfügige Kombination von φ1s mit den anderen Atomorbitalen wird vernachlässigt)
1σ » f1s
2σ ≈
0,323 φ2s + 0,231 φ2pz
+ 0,685 φH
setzt sich somit aus der inneren Schale (1σ)² des Litiumatoms zusammen, die mit der im freien Atom nahezu identisch ist, sowie aus dem bindenden 2σ-MO, das zwei Elektronen enthält. Das Li-2p-AO ist zugelassen, denn es liegt nur geringfügig höher als das 2s-AO, und nach dem Energiekriterium gibt es keinen Grund, das 2p-AO auszuschließen. In der LCAO-Entwicklung sollten wir alle Atomorbitale mit nicht zu unterschiedlicher Energie miteinander kombinieren lassen und die Lösungen der Säkulargleichungen abwarten; genau diese Vorgangsweise (Methoden werden später beschrieben) führt zur obigen Gleichung.
Wir möchten an dem sehr einfachen Prinzip festhalten, wonach die Molekülorbitale für zweiatomige Moleküle aus überlappenden Paaren von Orbitalen, wobei sich an jedem Atom nur eines befindet, gebildet werden können. Das ist möglich, wenn die Gleichung in der Form
2σ = 0,397 (0,813 φ2s + 0,582 φ2p) + 0,685 φH
Die AO-Koeffizienten in dem Hybrid
sind mit einem gemeinsamen Faktor multipliziert worden, damit das Hybrid normiert ist. Ganz allgemein muss dafür die Bedingung
ò (a φ2s + b φ2p)² dτ = a² + b² = 1
gelten (man beachte, dass die den Hybridorbitalen zugrundeliegenden Atomorbitale den Atomkern als gemeinsames Symmetriezentrum aufweisen und daher "gemischte" Integrale, wie ∫Φ2sΦ2pdτ verschwinden). Zur Kennzeichnung eines solchen sp-Hybrids wird häufig die Population, d.h. a² und b², als hochgestellter Index verwendet: s0661p0.339 (a=0,813, a² = 0,661 und b= 0,582, b²=0,339). Immer häufiger wird auch auf s normiert: sp0.51. Somit wird das bindende MO in LiH durch die Überlappung des H-1s-AO mit einem Li-Hybrid (h) gebildet (wobei der relative p-Anteil dem 0,51-fachen des s-Anteils entspricht):
2σ = 0,397 φh + 0,685 φH
Ein Hybridorbital ist also eine Linearkombination von Atomorbitalen
eines einzelnen Atoms. Ein sp-Hybridorbital
ist beispielsweise eine Funktion, die aus gleichen Anteilen von s- und
p-Orbitalen desselben Atoms besteht (s. Abb.1). Ein Elektron, das dieses
Orbital besetzt, hat dann 50% s-Charakter und 50% p-Charakter. In unserem
Ausgangsbeispiel des Li-Hybrids war der 2s-Anteil etwas größer
als der 2p-Anteil, er betrug 0,661:0,339 ≈
1,95:1 statt 1:1 wie bei einer 50:50 Beteiligung. Ein
sp³-Hybrid
besitzt 25% s- und 75% p-Charakter (das bedeutet, dass s- und p-Orbitale
im Verhältnis 1:3 beitragen). Ein
sp³d²-Hybrid
ist entsprechend ein Orbital, zu dem s-, p- und d-Funktionen im Verhältnis
1:3:2 beitragen.
Allgemein gilt, dass aus N Atomorbitalen N zueinander orthogonale
Hybridorbitale konstruiert werden können. Was beruhigend ist,
denn so geht uns kein Orbital durch die Hybridisierung verloren. Es gibt
also
zwei orthogonale sp-Orbitale (Bilder sp-OrbitaleY,
|Y|² als 3D und Konturplot)
drei orthogonale sp²-Hybride (Beispiele
für sp²: Y, |Y|²
als 3D und Konturplot)
vier orthogonale sp³-Hybride
und sechs sp³d²-Hybride.
Die Form der Hybridorbitale erhält man aus der Form der beitragenden
Atomorbitale unter Beachtung der konstruktiven bzw. destruktiven Interferenz,
die bei der Kombination auftritt. Die großen Lappen der sp-Hybridorbitale,
die aus einem s- und einem p-Orbital gebildet werden können, zeigen
in entgegengesetzte Richtungen. Der Winkel zwischen den Hybridorbitalen
wird um so kleiner, je höher der p-Anteil ist. Die vier sp³-Hybride,
die aus einem s.Orbital und einem Satz p-Orbitale entstehen, sind tetraedisch
um as Atom angeordnet, und die sechs sp³d²-Orbitale bilden ein
Oktaeder. Die Hybridorbitale werden stets so konstruiert, dass sie
in Bindungsrichtung zeigen (bzw. in Raumrichtungen, die den Positionen
von freien Elektronenpaaren entsprechen). Da alle hier erwähnten Hybridorbitale
auch auch etwas s-Charakter besitzen, hat keins von ihnen eine Knotenfläche
direkt am Ort des Kerns. Die Knotenflächen, die für p- und d-Orbitale
typisch sind, sind in den Hybridorbitalen leicht vom Kern weg verschoben
(Abb.1). Häufig vorkommende Hybridisierungen und die geometrische
Anordnung der zugehörigen Hybridorbitale sind in der Tabelle abgegeben.
| Tabelle 1: Einige typische Hybridisierungen | ||
| Koordinationszahl | Anordnung | Zusammensetzung |
|
|
linear
gewinkelt |
sp, pd, sd
sd |
|
|
trigonal
unsymmetrisch planar trigonal pyramidal |
sp², p²d
spd pd² |
|
|
tetraedisch
verzerrt tetraedisch quadratisch planar |
sp³, sd³
spd², p³d, pd³ p²d², sp²d |
|
|
trigonal bipyramidal
tetragonal pyramidal pentagonal planar |
sp³d, spd³
sp²d², sd4, pd4, p³d² p²d³ |
|
|
oktaedrisch
trigonal prismatisch trigonal antiprismatisch |
sp³d²
spd4, pd5 p³d³ |
Hybridorbitale wurden ursprünglich im Rahmen der Valenzbildungstheorie eingeführt, in der jede Bindung durch Überlappung je eines Orbitals zweier benachbarter Atome beschrieben wird. In dem tetraedischen Molekül CH4 werden die C-H-Bindungen beispielsweise durch Überlappung je eines H 1s-Orbitals mit einem der vier sp³-Hybridorbitale am Kohlenstoff erklärt. Bei der Beschreibung des trigonal pyramidalen Moleküls NH3 muss sich eines der vier Hybridorbitale von den anderen drei unterscheiden. Da der HNH-Winkel mit 107° kleiner als der Tetraderwinkel ist, müssen die Hybridorbitale, die die N-H-Bindung ausbilden, einen größeren p-Anteil aufweisen als ein sp³-Orbital. Zur Charakterisierung von Hybridorbitalen können die an einem Molekül identifizierten Winkel herangezogen werden. Zwischen dem Koeffizienten λ in einem spλ hybridisierten Atom und der Ausrichtung der Bindungen zu seinen Bindungspartnern gilt folgende Beziehung (hier am Beispiel des NH3, wobei φ den Bindungswinkel HNH symbolisiert)
| cos φ = −1/λ | 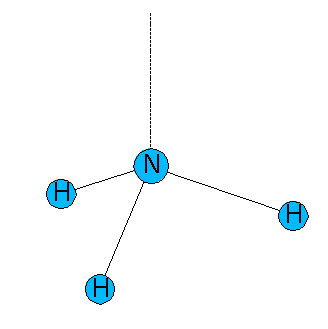 |
| a² = cos φ/cos φ −1 | b² = 1 - a² |
| a² = 0,226 | b² = 0,774 |
Ebenfalls aus dem Winkel &phi ergibt sich die Hybridisierung weiterer vorhandener, nicht aber an Bindungen beteiligter Hybridorbitale. Im Falle von NH3 nimmt das in der Molekülachse liegende Orbital das nichtbindende Elektronenpaar des N-Atoms auf. Da die Hybridorbitale der Bindung einen höheren p-Anteil haben, wird umgekehrt für dieses Orbital einen höherer s-Anteil aufweisen.
| h' = a's + b'p' | |
| a' 2 = 1 + cos φ/1 − cos φ | |
| a' 2 = 0,71/1,29 = 0,547 | ⇒ b2 = 0,453 |
| 0,453 : 0,547 = 0,83 | ⇒ sp0,83-Hybridorbital |
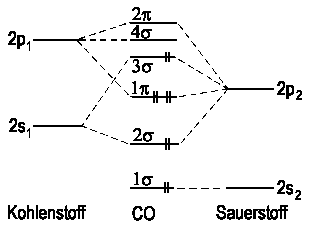 |
| Abb. 2a: Das Korrelationsdiagramm für das CO-Molekül ohne Hybridisierung. Das höchste besetzte MO (3σ) ist antibindend. |
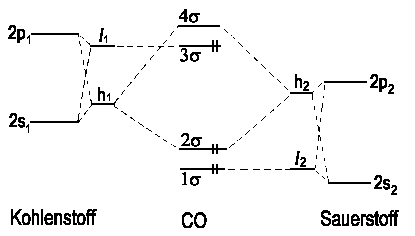 |
| Abb. 2b: Das Korrelationsdiagramm für das CO-Molekül mit Hybridisierung. Mit der verstärken Trennung der bindenden und antibindenden σ-MO wird das höchste besetzte MO (3σ) ein Orbital für ein einsames Elektronenpaar am Kohlenstoff, in Übereinstimmung mit dem Experiment. (Um die Übersichtlichkeit zu wahren, wurden die π-Niveaus weggelassen.) |
Im einzelnen wird die CO-Gruppe sehr leicht an Übergangsmetallionen gebunden., wobei das elektronenreiche Kohlenstoffende durch das positive Ion angezogen wird. Die Gruppen CN− und NO+ sind zu CO isoelektronisch und treten ebenfalls häufig in Übergangsmetallkomplexen auf, wobei die Bindung auf ähnliche Weise zu erklären ist.
Zusammenfassend kann festgestellt werden, dass das Konzept der Hybridisierung in der qualitativen Bindungstheorie von großer Bedeutung ist. Dieses Konzept liefert uns im Vorhinein die wichtigsten Ergebnisse einer vollständigen wellenmechanischen Berechnung: Die Paarung der Orbitale mit vergleichbaren Energien und eine ausreichende Überlappung .
![]()
Auf diesem Webangebot gilt die Datenschutzerklärung der TU Braunschweig mit Ausnahme der Abschnitte VI, VII und VIII.