Die Maxwellsche Geschwindigkeitsverteilung gibt uns die Zahl der Moleküle in einem Geschwindigkeitsintervall an, woraus wir natürlich sofort durch Integration die relative Anzahl der Moleküle P(v>vs) (oberhalb einer Schwellgeschwindigkeit vs berechnen können: P(v>vs) = vsò¥ F(v)dv. Für chemische Reaktionen benötigen wir jedoch die Energie, die notwendig ist, um z.B. eine Energiebarriere zu überwinden, oder um überhaupt eine Reaktion energetisch zu ermöglichen, denn es können natürlich nur die Teilchen reagieren, deren Energie ausreiched ist, um die (eventuelle) Energielücke zwischen Edukten und Produkten zu überwinden. Wir müssen also die Geschwindigkeitsverteilung F(v) in eine kinetische Energieverteilung G(E) umrechnen (Das Symbol G( ) wurde nur gewählt, um die andere mathematische Form dieser Verteilung hervorzuheben) :
E = ½ mv2 → v = (2E/m)½ dE/dv = mv ® dv = dE/(mv) = dE/(2mE)½
Da G(E)dE = F(v)dv gelten muss, erhalten wir durch Einsetzen in die
Maxwell-Verteilung:
|
|
Interessant ist, dass die Masse der Spezies nicht mehr in der Gleichung
enthalten ist. Der Verlauf von G(E) als Funktion der kinetischen Energie
E (in Einheiten von kT) ist in Abb.1 dargestellt. Für Raumtemperatur
T=298 ist beispielsweise kT = 2,5kJ/mol. Eine Erhöhung der Temperatur
um nur 30% bewirkt bereits eine deutliche Zunahme der Teilchen, deren Energie
grösser als (beispielsweise) 3kT ist.
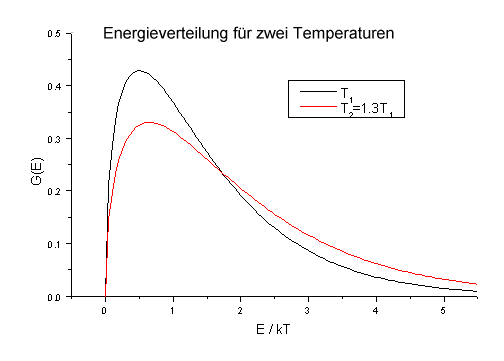 |
| Abb.1: Kinetische Energieverteilung nach Maxwell-Boltzmann für zwei unterschiedliche Temperaturen. |
![]()
Wir wollen uns nun ganz allgemein die molekulare Verteilungsfunktion für die Energie überlegen, wobei wir von den folgenden Voraussetzungen ausgehen:
wobei das (letzte) Gleichheitszeichen gilt, da wir annehmen, dass die Teilchen unabhängig voneinander sind. Nur die Exponentialfunktion erfüllt diese Gleichung (Herleitung):
Die Konstante β bestimmen
wir durch Vergleich mit dem obigen Spezialfall: β
= -1/kT. Den Proportionalitätsfaktor
bestimmen wir wiederum durch Normierung, d.h. die Gesamtwahrscheinlichkeit
muss 1 sei. Die Wahrscheinlichkeit P(E) ein Teilchen mit der Energie E
vorzufinden nimmt also exponentiell mit E ab und ein solcher Verlauf ist
in der unteren rechten Abb.2 dargestellt. Die linke Seite der Abb.2 zeigt
etwas anschaulicher, wie mit zunehmender Energie die Wahrscheinlichkeit,
ein Molekül mit solcher Energie zu finden, abnimmt.
| Abb.2: Die Wahrscheinlichkeit N(E)/N ein Teilchen bei der Energie E zu finden nimmt exponentiell mit E ab: N(E) ~ e-E/kT (rechts). Die linke Abb. zeigt, wie die Besetzungszahl N(E) bei der niedrigst möglichen Energie Eo am grössten ist und mit zunehmender Energie exponentiell abnimmt. |
Wenn wir die Energiewerte kennen, die unsere Teilchen annehmen können,
dann ist der Bruchteil N(E)/N
der Teilchen, die diesen Energiewert besitzen, gegeben durch:
|
|
Dank der Quantenmechanik weiss man z.B., dass Moleküle ganz charakteristische
Schwingungen besitzen, die wiederum der Identifikation des Moleküls
und dessen Strukturaufklärung durch die Spektroskopie dienen. Einem
Schwingungstypus können nun einzelne Energien E0, E1,
E2,... mit äquidistanten Abständen (idealisierter
harmonischer Oszillator) zugeordnet werden. Mit Hilfe der obigen
Gleichung können wir nun ausrechnen, wieviele Moleküle im niedrigsten
Schwingungszustand, oder in irgendeinem höher angeregten Zustand sind.
Falls die Teilchen unterschiedliche Zustände einnehmen
können, die aber die gleiche Energie haben, dann spricht man
von der Entartung eines Zustandes. Der Grad der Entartung, d.h. wieviele
unterschiedliche Zustände die gleiche Energie E haben, wird mit g(E)
bezeichnet. Ein einfaches Beispiel zur Entartung ist die Knickschwingung
des linearen CO2-Moleküls: O - C - O. Die Schwingung
kann in der Zeichenebene (nach "oben" und "unten") erfolgen oder senkrecht
dazu (nach "vorn" oder "hinten"). Die Energie der Schwingung muss
gleich sein, also ist die Schwingung zweifach entartet, d.h. g = 2.
Wir müssen diese entarteten Zustände natürlich in unserer
Boltzmannverteilung mit berücksichtigen und es gilt ganz allgemein:
| N(E) ~ g(E) e-E/kT |
Dies ist das Boltzmannsche
Energieverteilungsgesetz. Wir können nun noch formal die Normierung
durchführen:
|
|
wobei die Grösse Q Zustandssumme (im englischen "partioning function")
genannt wird:
|
|
Obwohl die Zustandssumme an dieser Stelle ganz unscheinbar eingeführt wurde, so hat sie doch eine gewaltige Bedeutung für die Spektroskopie, Statische Thermodynamik und die Reaktionsdynamik. Doch wir wollen den Ereignissen nicht vorgreifen.
![]()
Auf diesem Webangebot gilt die Datenschutzerklärung der TU Braunschweig mit Ausnahme der Abschnitte VI, VII und VIII.