Wir wollen nun den beim Lindemann-Hinshelwood-Mechanismus angesprochenen Übergangszustand präzisieren, um die molekulare Reaktionsdynamik besser zu verstehen. Wir werden dabei zu statistischen Beschreibungen kommen, die uns erlauben, den Zahlenwert der Geschwindigkeitskonstante zu bestimmen. Zur Illustration des Übergangszustandes betrachten wir eine einfache Atomaustauschreaktion (Abb.1) A+BC → AB+C, bei der ein Atom A mit dem zweiatomigen Molekül BC reagiert , was zum Produktmolekül AB und dem Atom C führt.
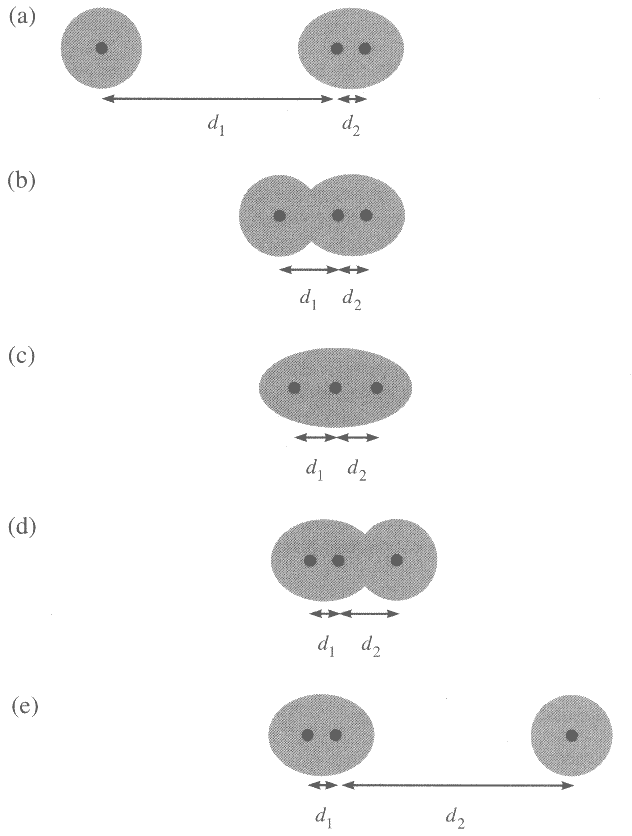 |
| Abb. 1: Reaktion A+BC → AB+C bei linearer Annäherung (a,b) über den aktivierten Komplex (c). |
Abb. 2 und 3 zeigen, wie sich im Verlauf der Wasserstoffaustausch-Reaktion
D + H2 → DH + H (Abb.2) und Cl
+ HI → HCl + I (Abb.3) die potentielle Energie
der an der Reaktion beteiligten Teilchen ändert.
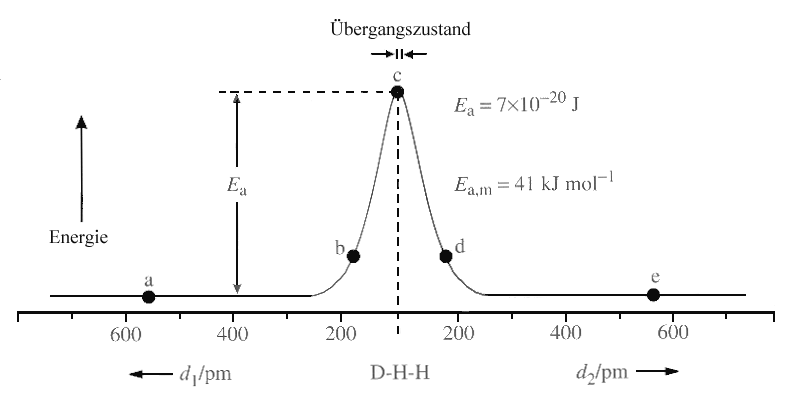 |
| Abb. 2: Energie des Stosssystems bei den unterschiedlichen Stadien der Reaktion D+H2→ HD+H. |
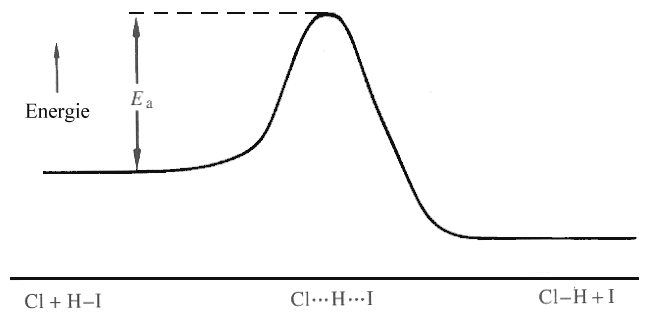 |
| Abb. 3: Energiediagramm für die Reaktion Cl + HI → HCl + I (ΔrH = -133 kJ mol-1). |
Zu Beginn der Reaktion (Abb. 1a) sind nur die Teilchen A und BC vorhanden, und ihre potentielle Energie hat einen bestimmten Wert. Wenn sich A und B nähern (Abb. 1b) steigt die potentielle Energie bis zu einem Maximum an (Abb. 1c) und fällt wieder ab, wenn sich die Reaktionsprodukte voneinander entfernen (Abb. 1d), bis sie einen Endwert erreicht, der für die Reaktionsprodukte charakteristisch ist (Abb. 1e). Die horizontale Achse in den Diagrammen (2) und (3) gibt den Ablauf der Reaktion an; wir nennen sie die Reaktionskoordinate. Der Höhepunkt der Reaktion entspricht dem Maximum der potentiellen Energie; an diesem Punkt sind die Teilchen einander so nahe und so stark deformiert, dass die geringste Verformung genügt, um die Reaktion in Richtung auf die Produkte ablaufen zu lassen. Man nennt diese Konfiguration auch den Übergangszustand der Reaktion. Ein Teil der Moleküle, die den Übergangszustand erreicht haben, fallen wieder zurück auf die Seite der Ausgangssubstanzen; wenn sie aber erst einmal über die Konfiguration des Übergangszustandes hinaus sind, werden die Reaktionsprodukte unvermeidlch gebildet.
Betrachten wir z.B., wie sich ein Wasserstoffatom einem D2-Molekül nähert (Abb. 2); der Einfachheit halber soll das längs der Richtung der D-D-Bindung geschehen. Zu Beginn, bei großen Abstand, ist die potentielle Energie gleich der Summe der potentiellen Energien von H und D2. Wenn sich H und D2 einander so weit genähert haben, dass die Orbitale anfangen, sich zu überlappen, dann beginnt die D-D-Bindung, sich zu dehnen, und ihre Energie nimmt zu. Zwischen H und dem nächsten D-Atom setzt jetzt die Ausbildung einer chemischen Bindung ein: Das H-Atom nähert sich immer mehr dem D-Atom; die D-D-Bindung wird länger und schwächer und gleichzeitig die H-D-Bindung kürzer und stärker. Irgendwann wird ein Zustand erreicht, in dem der sogenannte aktivierte Komplex das Maximum der potentiellen Energie erreicht hat (Punkt c). Dieser Zustand entspricht dem oben definierten Übergangszustand. Hier ist nur noch eine sehr kleine Kompression der H-D-Bindung oder eine sehr kleine Dehnung der D-D-Bindung nötig, um den aktivierten Komplex über den Übergangszustand in Richtung der Produkte zu führen. Geht man längs der Reaktionskoordinate weiter nach rechts, so durchläuft man Zuständen, in denen die H-D-Bindung immer fester und die D-D-Bindung immer lockerer wird, bis sie bricht. Die Bewegung entlang der Reaktionskoordinate von links nach rechts entpricht also einer Entwicklung, bei der D und HD über diese Konfiguration freigesetzt werden. Ob ein Stosspaar die Potenzialbarriere überwindet, hängt von seiner kinetischen Energie ab, die so hoch sein muss, dass es den energiereichen Übergangszustand erreichen kann.
In Wirklichkeit treffen die H-Atome aus allen Raumrichtungen auf die D2-Moleküle, deshalb kann man schwierig die Reaktionskoordinate nur für einen Winkel genau definieren. Wir werden sie daher hier nur als ein qualitatives Maß für die Deformationen ansehen, die die reagierenden Teilchen erleiden, wenn der aktivierte Komplex gebildet wird. Hier gibt es ein Filmchen für den Verlauf der Reaktion Cl + HI → HCl + I bei unterschiedlichen Reaktionsgeometrien. In der unmittelbaren Umgebung des Übergangszustandes entspricht die Reaktionskoordinate einer komplizierten, schwingungsähnlichen, kollektiven Bewegung aller Atome.
![]()
Auf diesem Webangebot gilt die Datenschutzerklärung der TU Braunschweig mit Ausnahme der Abschnitte VI, VII und VIII.