Vor mehr als einem halben Jahrhundert zeigten die "Atomflammen"-Experimente von M. Polanyi, dass in Reaktionen wie
K + Br2 → KBr† + Br
das neugebildete Salzmolekül KBr in der Schwingung hochangeregt ist (was wir mit † kennzeichen). Diese Anregung ist so hoch, dass in einem nachfolgenden Stoss mit einem Alkaliatom elektronische Anregung erfolgen kann:
KBr† + K → KBr + K*
Das angeregte Alkaliatom K* gibt seine Energie durch Fluoreszenz (d.h. Lichtemission) ab:
K* → K + hν,
was zu einer sichtbaren "Flamme" mit der für das Alkai-Metall typischen Farbe führt.
Zur gleichen Zeit benutzen Eyring, Polanyi, Evans und andere eine Form der London-Gleichung, um zum ersten Mal realistische Potentialflächen zu berechnen, und versuchten dann, die Dynamik solcher reaktiver Stöße (einschließlich der Schwingungsanregung der Produkte) mit Hilfe dieser Flächen zu interpretieren. Seit dieser Zeit wird die Energieaufteilung in exoergischen Reaktionen duch Analyse klassischer Trajektoren auf Potentialflächen interpretiert.
Eines der qualitativen Ergebnisse, die sich ergaben. lautet wie folgt:
Für gegebene Reaktandenmassen und nicht zu hohe Stoßenergie
ist der Wirkungsgrad der Umsetzung der Exoergizität der Reaktion in
Schwingungsenergie des Produkts um so höher, je früher die Exoergizität
freigesetzt wird.
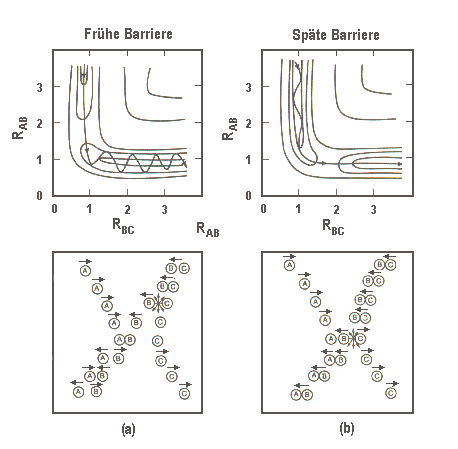 |
| Abb.
1: Schematische Darstellung von (a) einer frühzeitigen, ("attraktiven")
Energiefreisetzung auf einer Energiefläche mit früher Barriere
und (b) einer späten ("repulsiven") Freisetzung bei später Barriere.
In (a) wird die Exoergizität frei, während das Atom A
und das Molekül BC sich noch nähern, was zur Schwingungsanregung
des Produktes AB führt. In (b) wird die Energie erst frei, wenn A
schon nahe bei BC und fast zur Ruhe gekommen ist, so dass das Produkt AB
einen Rückstoß erleidet, und der größte Teil der
Energie als Translationsenergie der Produkte frei wird.
(Nach J.C. Polanyi: Acc. Chem. Res., 5, 161 (1972)) |
Das untere Bild in Abbildung 1 zeigt in vereinfachter Form die Verhältnisse. Eine frühe Freisetzung der Exoergizität, während noch das angreifende Atom A sich den Reaktanden BC nähert, führt zu einer Abstoßung zwischen A und B bei kleinen Abständen und überträgt die Exoergizität in Schwingung der Produkte. Parallel dazu zeigt der oberer Teil der Abbildung 1 eine typische Trajektorie auf der zughörigen Potentialfläche. Die frühzeitig freigesetzte Exoergizität erscheint zunächst als kinetische Energie in der AB-Richtung. Das führt zum sogenannten "Bobbahn-Effekt": Wo die "Wände" des Potentials gekrümmt sind (weil AB- und BC-Abstoßung einsetzt), kann die Trajektorie nicht mehr weiter der Talsohle (dem Weg niedrigster potentieller Energie) folgen, sondern führt wegen des großen Impulses an Ab-richtung zunächst ziemlich geradeaus. Das führt sie auf die Wand der "Bobbahn" hinauf. Damit hat der Einfluß der frühen Anziehung und der kurzreichweitigen AB-Abstoßung die Exoergizität in Schwingung des Produktes AB verwandelt.
Bisher hat die ganze Diskussion der Beziehung zwischen den Topografie der Potentialflächen und der Dynamik des Systems eine wichtige Frage vernachlässigt: den Einfluß der Massen der Teilchen auf das Verhalten des Systems. Es wurde schon früh erkannt, dass es auf jeder gegebenen Potentialfläche starke Masseneffekte gibt (schließlich enthalten Newtons Gleichungen die Masse als Faktor!). Um diese Effekte besonders übersichtlich zu machen, hat man massengewichtete Koordinaten eingeführt und zur Darstellung der Potentialflächen benutzt.
In dieser Darstellung kann man das System mit der reibungsfreien Bewegung eines Punktteilchens auf einer realen Oberfläche unter dem Einfluß der Schwerkraft identifizieren (vgl. Massengewichtete Koordinaten). Man kann damit den Einfluß anfänglicher Translationsenergie oder anfänglicher Schwingungsenergie auf die Trajektorien und die Aufteilung der Exoergizität noch leichter verstehen.
Wegen des Masseneffekts ist es möglich, hohe Schwingungsanregung der Produkte selbst auf einer ("abstoßenden") Fläche mit später Energiefreisetzung zu bekommen, wenn nur der wichtige Massenfaktor cos2β von
E'tr = (mAmC/mACmBC) Etr = cos2β Etr
nahe bei eins liegt. In diesem Grenzfall ist das ausgetauschte Atom sehr leicht, daher wird selbst auf einer "abstoßenden" Fläche die Exoergizizät freigesetzt, während noch das heranfliegende Atom sich weiter nähert.
Der Sohn von M. Polanyi, John C. Polanyi (Nobelpreis für Chemie, 1986) hat aufgrund experimenteller Daten bestimmt, wie sich die potenzielle Energiefläche auf die Form der freiwerdende Produktenergien auswirkt, aber auch wie die Energie der Edukte "beschaffen" sein muss, um effektiv eine Energiebarriere zu überwinden.
Der entscheidende Punkt ist, wie weiter oben erläutert, die Position
der Energiebarriere und der Verlauf der potentiellen Energie entlang des
Reaktionsweges der minimalen Energie (Hyperpotentialflächen,
Abb. 2). Natürlich muss zunächst die Gesamtenergie E
ausreichen, um die Energiebarriere Eb zu überwinden; für
E < Eb kehrt das System zurück
in das Ausgangstal, ein nichtreaktiver Stoß hat stattgefunden. Liegt
die Energiebarriere früh auf dem Reaktionsweg, d.h. findet die Reaktion
bei relativ großen Abstand A-BC statt (attraktive Potentialfläche),
was man bei Reaktionen mit großem Wirkungsquerschnitt erwartet, dann
ist eine hohe Translationsenergie am effektivsten, um die Energiebarriere
zu überwinden. Die freiwerdende Energie wird im wesentlichen in vibronische
Anregung des neuen AB-Moleküls umgewandelt werden (Abb. 2 links oben).
Der Trend zu hoher vibronischer Anregung nimmt jedoch nicht unbegrenzt
zu: je früher die Energiebarriere im Reaktionsweg liegt, d.h. je attraktiver
das Potential ist, um so eher nimmt die Wahrscheinlichkeit zu, dass die
Partikel ein zweites Mal stoßen. Dies geschieht immer dann, wenn
AB relativ zu C mit so geringer translatorischer Energie gebildet wird,
dass die große Schwingungsamplitude das Atom C nochmals erreicht,
bevor es sich as dem Staub gemacht hat. Diese zweite Bewegung ermöglicht
einen Fluß der Vibrationsenergie in andere Freiheitsgrade der Reaktionsprodukte.
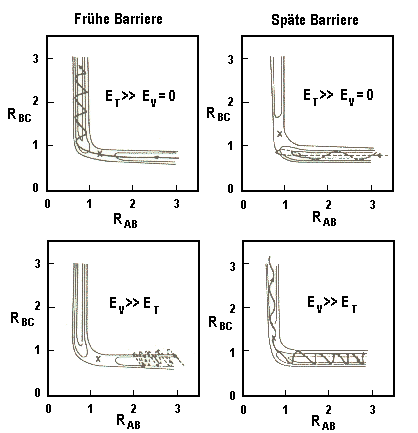 |
| Abb.
2: Einfluß der Energiezufuhr durch die Reaktanden auf eine thermoneutrale
Reaktion A + BC →
AB + C, die auf einer Potenzialfläche mit einer Barriere bei x abläuft.
In allen 4 Fällen ist E > Eb (Barrierenenrgie), so dass
die Reaktion energetisch erlaubt ist. Ist die Translationsenergie hoch
(obere Bilder), so ist der Impuls entlang RAB groß: Eine
Reaktion findet statt, wenn die Barriere im Eingangstal ist (links), jedoch
nicht, wenn die im Ausgangstal ist (rechts). Umgekehrte Verhältnisse
findet man, wenn das Diatom zwar hohe Schwingungsenergie besitzt, aber
die Translationsenergie niedrig (hier: niedriger als die Barriere) ist.
Die Schwingungsenergie, d.h. kinetische Energie der RBC-Bewegung hilft
bei einer späten Barriere.
(Nach J.C. Polanyi, W.H. Wong: J. Chem. Phys., 51, 1439 (1969)) |
Liegt die Barriere spät auf dem Reaktionsweg, d.h. hat sich bereits das neue Molekül AB gebildet, bevor die Energie frei wird (repulsive Potentialflächen), dann fließt die Energie vornehmlich in die relative Translation der beiden Produkte. Beschleunigt wird die Reaktion durch vibronische Anregung des Reaktanten BC (Abb. 2 unten rechts). So wie man für eine frühe Barriere die Energie entlang RAB benötigt, braucht man für eine späte Barriere die Energie in Richtung der RBC-Koordinate, um die Reaktion zu beschleunigen. Die Form der benötigten Energie wird aber immer unwichtiger, je größer die Stoßenergien sind, weil dann ein effektiver Austausch zwischen Vibrations- und Translationsenergie entlang dee Rotationsweges immer wahrscheinlicher wird.
Bei dieser Überlegung beüglich des Zusammenhanges zwischen der Hyperfläche und der Dynamik einer Reaktion wurde jedoch bisher der entscheidende Einfluß der Masse der Atome auf das dynamische Verhalten des Systems vernachlässigt. Um diesen Einfluß zu beschreiben, führt man ein massegewichtetes Koordinatensystem ein. Die in Abbildung 1 und 2 gezeigten Koordinaten sind dann nicht mehr rechtwinklig, sondern das Reaktanten-Eingangstal und das Produkt-Ausgangstal stehen dann in einem Winkel b¹ 90° zueinander. Dieser Winkel β hängt nur von der Masse ab:
cos2 β = mAmC/(mA+mB)(mB+mC)
Die kinetische Energie ist dann die eines Massenpunktes mit der Masse eins in einem neuen kartesischen Koordinatensystem. Wenn der Winkel β nur hinreichend groß ist, dann können unabhängig von der Lage der Energiebarriere vibronisch angeregte Produktmoleküle entstehen. Kleine Winkel (d.h. cos2β ≈ 1) erhält man immer dann, wenn mB klein ist, also das übertragene Atom sehr leicht ist.
Mit Hilfe dieser einfachen Massenbeziehung kann man leicht ableiten, wir groß maxixmal die Anteile der Vibration und Translation an der gesamten freiwerdenden Energie E sind:
Etrans = E · cos2 β
Evib = E · sin2 β
ist die maximale Vibrationsenergie von AB bei einer kollinearen Anordnung durch
Evib = E · sin2 β' ,
wobei β' wiederum nur von den Massen abhängt:
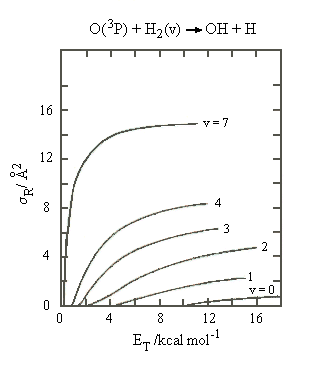 |
| Abb.
3: Reaktionsquerschnitt als Funktion der Translationsenergie für
die Reaktion von O(3P) mit H2 in vorgegebenen Schwingungszuständen
v. Ergebnisse einer klassischen Trajektorienrechnung auf der halbempirischen
Potentialfläche von Bild 4.12 (????).
(Nach M. Broida, A. Persky: J. Chem. Phys., 80, 3687 (1984)) |
tan2 β' = mBM/ mA(mC + mD)
M = mA+mB+mC+mD
Diese Erfordernisse können anhand von Abbildung 2 interpretiert werden, indem man feststellt, ob kinetische Energie "in der richtigen Koordinate" vorhanden ist. Für eine frühe Barriere wird Impuls entlang RAB benötigt, während die Überwindung einer späten Barriere Impuls in Richtung RBC-Richtung braucht. Diese energetischen Erfordernisse werden offensichtlich weniger restriktiv sein, wenn die Stoßenergie hoch oder cos2β ≈ 1 ist, da dann ein wirkungsvoller Austausch von Schwingungs- und Translartionsenergie entlang des Reaktionsweges wahrscheinlicher wird.
Abbildung 3 zeigt berechnete Ergebnisse für die Reaktion
O(3P) + H2(v) → OH + H
Dargestellt ist der Querschnitt gegen die Translationsenergie für verschiedene Schwingungszustände des H2.
Man sieht, dass nicht alle Formen der Energie gleich wirksam die Reaktion befördern. Die relative Bedeutung von Translations- bzw, innerer Energie für die Überwindung der Potentialbarrieren ist zur Zeit ein Thema akiver Forschung, sowohl theoretisch wie experimentell.
![]()
Auf diesem Webangebot gilt die Datenschutzerklärung der TU Braunschweig mit Ausnahme der Abschnitte VI, VII und VIII.